EGFR是多种癌症类型中具有明确临床疗效的治疗靶点。本研究旨在明确转移性多癌种患者中EGFR变异的发生情况及其与其他基因变异的关联性。 本研究采用三星医疗中心3286例转移性癌症患者的下一代测序(NGS)真实世界数据,分析EGFR扩增、突变及融合的分布特征,以及其与微卫星不稳定性(MSI)、肿瘤突变负荷(TMB)及其他基因变异的相关性。
2019年10月至2022年10月期间,3286例患者在临床实践中接受了涵盖523个癌症相关基因的NGS检测。肺癌和胶质瘤患者未纳入分析。在3286例患者中,5.3%(n=175)存在EGFR扩增,1.2%(n=38)存在EGFR突变,0.2%(n=8)存在EGFR融合。175例EGFR扩增患者均为微卫星稳定(MSS)肿瘤,其中102例合并其他癌症相关基因的共扩增,78例存在具有临床意义的突变(1级/2级)。38例EGFR突变患者中,8%(n=3)为微卫星高度不稳定(MSI-H)状态,29%(n=11)为高TMB(≥10 mut/Mb)。8例EGFR融合患者中,3例显示出EGFR基因的潜在功能活性。
6.4%的转移性实体瘤患者存在EGFR变异,其中以扩增最为常见,其次为突变和融合。
研究背景
EGFR是一种受体酪氨酸激酶,也是最强的致癌驱动因子之一。EGFR通过二聚化激活,经PI3K、RAS及JAK/STAT通路介导下游信号传导,参与细胞增殖、存活及迁移过程。因此,EGFR被视为靶向治疗的主要靶点,例如结直肠癌(CRC)治疗药物抗EGFR抗体西妥昔单抗,以及非小细胞肺癌(NSCLC)治疗药物EGFR TKIs厄洛替尼和吉非替尼,近二十年来已得到广泛研究。然而,尽管EGFR TKIs在NSCLC中取得成功,但这些药物在其他癌症中的疗效尚未达到改变治疗范式的程度。此外,尽管已在多种癌症中发现EGFR变异,但这类变异对其他癌症的治疗效果尚未显现显著临床价值。因此,相关未被满足的临床需求仍未得到解决,患者结局仍受限制。
下一代测序(NGS)正在改变临床实践,其可在单次检测中同时检出多种基因组变异。NGS技术的发展为患者和临床医生提供了新的临床机会,在深化对癌症基因组认知的同时,将治疗领域拓展至此前难以触及的方向。然而,目前对EGFR变异的认知仍有限。已有研究利用癌症基因组图谱(TCGA)数据集分析了不同肿瘤类型中EGFR变异与患者生存的关联性,但在接受姑息化疗的转移性癌症患者中,EGFR变异的临床意义尚未明确。
本研究通过泛癌种NGS分析,明确了EGFR变异的发生频率和类型,并探究其与生存结局的关联,同时鉴定了其他相关癌症基因,旨在确立EGFR变异的临床意义。
分子靶点
患者特征:
2019年10月至2022年10月期间,三星医疗中心在临床实践中对3286例Ⅳ期癌症患者进行了涵盖523个癌症相关基因的NGS检测(TSO500,Illumina)。由于EGFR基因在肺癌中的独特性,本研究排除了肺癌患者;此外,胶质瘤患者的相关数据已在另一项研究中进行过深入分析,故亦未纳入本研究。该队列中最常见的癌症类型为结直肠癌(CRC,n=1117,34%)、胃癌(GC,n=793,24.1%)和胆管癌(CCC,n=271,8.2%)(图1A)。总体而言,6.4%(n=209)的患者肿瘤样本中存在EGFR变异(图1B),具体包括5.3%(n=175)的EGFR扩增、1.2%(n=38)的EGFR突变和0.2%(n=8)的EGFR融合。EGFR扩增最常见于CRC(n=83),其次为GC(n=41)、CCC(n=11)、黑色素瘤(n=8)、肉瘤(n=7)和胆囊癌(n=6)(图1C);EGFR突变最常见于CRC(n=15),其次为GC(n=8)、CCC(n=6)和膀胱癌(n=4)(图1D)。
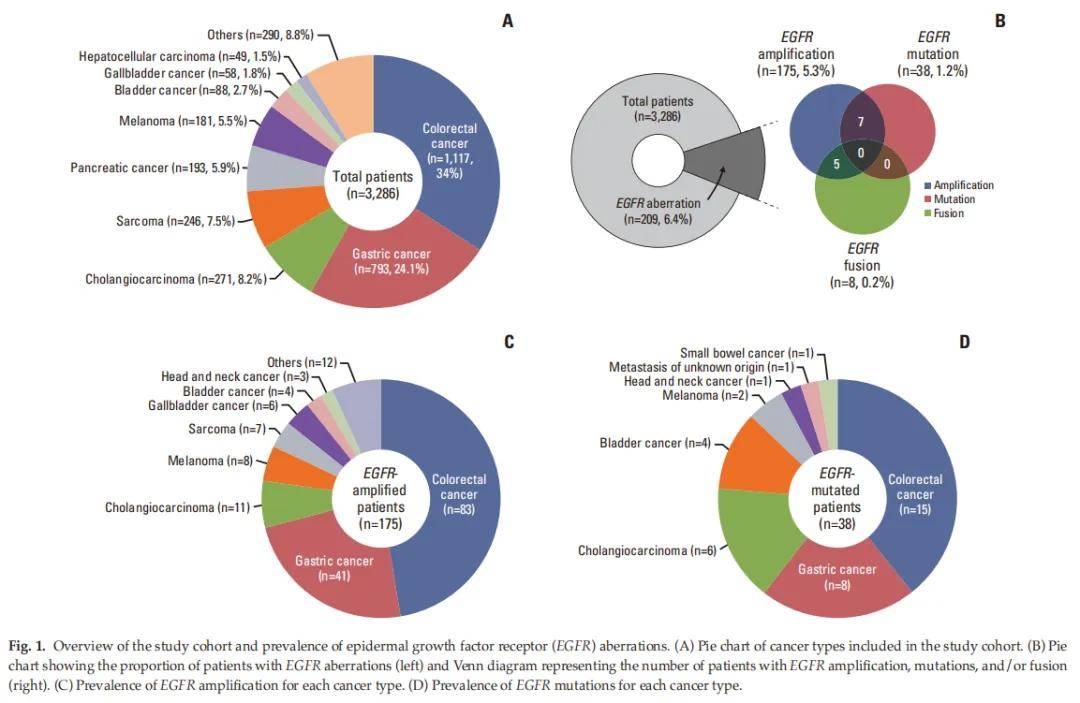
图1
EGFR扩增:
175例EGFR扩增患者的EGFR拷贝数范围为3.0-324.8(中位值5.4),其中76%的患者拷贝数小于10(x<5:n=74,42%;5≤x<10:n=59,34%)(图2A)。值得注意的是,少数患者拷贝数超过100:7例GC患者(102.1-324.8)、2例CRC患者(138.8和168.8),以及各1例胰腺癌(2232.5)、CCC(189)、头颈部癌(145)和小肠癌(126.9)患者。小肠癌患者的平均拷贝数最高(126.9),其次为胰腺癌(118.8)和头颈部癌(50.8)(图2B);而前列腺癌和肾癌患者的平均拷贝数最低(均为4.0)。为明确7号染色体多体性,本研究评估了位于7号染色体上的其他癌基因拷贝数增加的共发生情况,发现2例患者(1例CCC、1例胰腺癌)的4个基因(EGFR、MET、CDK6和BRAF)均存在拷贝数增加。

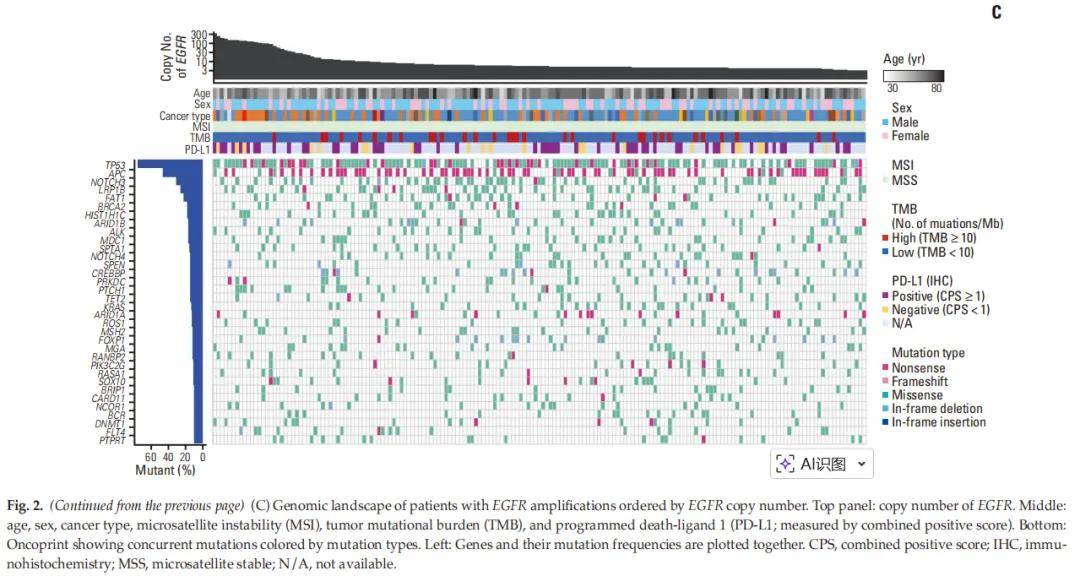
图2
本研究进一步分析了EGFR扩增与其他基因组特征(包括基因突变)的关联性(图2C)。EGFR扩增肿瘤均为微卫星稳定(MSS),18%(32/175)为高TMB(≥10 mut/Mb),69%(52/75)为PD-L1阳性(CPS≥1)。最常见的共突变基因为TP53(n=132,75%),其次为APC(n=81,46%)、NOTCH3(n=55,31%)、LRP1B(n=46,26%)和FAT1(n=40,23%)。在EGFR扩增肿瘤中检测到的3331个突变中,45%(78/175)的患者存在101个具有临床意义的突变(1级/2级),其中以KRAS突变最为常见,其次为PIK3CA、TP53和BRAF。此外,58%(102/175)的EGFR扩增患者存在179个其他癌症相关基因的共扩增,最常见于MYC,其次为RICTOR、MET、ERBB2、KRAS和MDM2;其中73例患者存在101个具有临床意义的共扩增(1级/2级),以MET扩增最为常见,其次为ERBB2、MDM2和PIK3CA。
EGFR突变:
38例EGFR突变患者中,36例为单一突变,2例为双重突变。最常见的单核苷酸变异类型为C→T(n=17),其次为C→A(n=6)和T→G(n=4)(图3A)。反复出现的突变位于近膜结构域(L675R、R677C/H、G682D和I698T)、激酶结构域(D770_N771insGL和V786M)及C末端尾部(A1048V)(图3B),其中仅L675R和V786M突变在3例患者中检出,其余突变均在2例患者中检出。激酶结构域的其他突变还可见于CRC患者(Y727N、E746_A750del和R836C)、黑色素瘤患者(L747_T751del)、膀胱癌患者(S768I)和头颈部癌患者(H773dup)。EGFR突变肿瘤中,8%(3/38)为MSI-H,29%(11/38)为高TMB,82%(14/17)为PD-L1阳性(图3C)。最常见的共突变基因为TP53(n=26,68%)、BARD1(n=14,37%)、NOTCH3(n=13,34%)、BRCA2(n=11,29%)和LRP1B(n=11,29%)。


图3
EGFR融合:
8例EGFR融合患者中,2例为GC、2例为CRC、2例为膀胱癌、1例为小肠癌、1例为肉瘤。1例CRC患者检出4个融合事件,1例小肠癌患者检出2个融合事件,其余患者各检出1个融合事件。在12个融合事件中,2个为框内EGFR融合,5个为框外EGFR融合,其余5个存在内含子断裂点。在7个框内或内含子断裂点融合事件中,仅1例CRC患者的融合事件包含完整的EGFR激酶结构域(18-24号外显子),2例膀胱癌患者的融合事件包含部分EGFR激酶结构域,其余4个融合事件均缺失EGFR激酶结构域。详细的融合信息见表1和图4A-C。因此,3例患者的EGFR融合事件可能具有EGFR基因功能活性。

表1

图4
讨 论
本研究通过三星医疗中心的NGS检测数据显示,3286例转移性癌症患者中,209例(6.4%)存在EGFR变异,其中包括175例(5.3%)EGFR扩增、38例(1.2%)EGFR突变和8例(0.2%)EGFR融合。此外,7例患者同时存在EGFR扩增和突变,5例患者同时存在EGFR突变和融合。
除小肠癌和胰腺癌(中位拷贝数>30)外,所有癌症类型的EGFR扩增中位拷贝数均<10。然而,在占比最高的CRC、GC和胆道系统癌症中,未观察到拷贝数改变的显著差异。值得注意的是,所有EGFR扩增患者均为MSS状态,这与我们此前的研究发现(所有HER2扩增患者均为MSS状态)一致。本研究推测,MSI-H状态下可能无法实现精准的DNA复制,这一结论也与一项转移性CRC研究的结果相符——该研究中所有EGFR扩增患者均为MSS状态。鉴于MSS肿瘤患者存在未被满足的临床需求,明确此类患者中具有临床可干预的基因组变异至关重要。
EGFR突变以错义突变为主,部分患者的突变位于近膜结构域而非激酶结构域,这与NSCLC存在显著差异——NSCLC的EGFR突变主要集中在激酶结构域的19号外显子缺失或21号外显子L858R突变。EGFR近膜结构域突变可通过诱导PIP2定位、激活PI3K通路或稳定EGFR家族二聚化促进细胞增殖,但同时也在受体酪氨酸激酶中发挥自身抑制作用,其在肿瘤发生发展及预后中的具体作用尚不清楚。这些结果提示,EGFR TKIs可能对除NSCLC外的其他癌症疗效有限,因为后者的突变主要集中在ATP结合位点。然而,有证据表明奥希替尼对携带EGFR T790M突变的CRC具有一定疗效,因此突变位点可能成为预测EGFR突变肿瘤对EGFR TKIs敏感性的生物标志物。
本研究共检测到12个EGFR融合事件,仅3个可能具有EGFR基因功能活性。框外融合会破坏阅读框架,通常因提前出现终止密码子导致蛋白失活;而内含子断裂点融合一般可保留编码外显子的阅读框架,从而产生功能性蛋白。根据融合基因数据库及近期EGFR融合相关研究,这3个具有潜在功能的融合事件中的伴侣基因均为首次报道。鉴于既往研究显示EGFR融合在胶质瘤和肺癌中发生率较高,本研究排除了这两种癌症类型,可能是导致EGFR融合检出率较低的原因之一。
EGFR抑制剂与其他靶向药物联合治疗时,需要进行全面的生物标志物评估。例如,恩曲替尼联合西妥昔单抗或帕尼单抗已获批用于携带BRAF V600E突变的CRC。此外,HER2和MET扩增是公认的EGFR抑制剂耐药机制,这类患者可能从双通路抑制中获益。事实上,EGFR-MET双特异性抗体埃万妥单抗在1b/2期研究中对CRC显示出良好疗效,目前正处于针对胃食管癌的2期临床试验阶段(NCT05117931)。既往针对胃食管癌的研究报道,70%的EGFR扩增患者存在其他可靶向癌基因的共扩增,且共扩增程度与EGFR抑制剂治疗后的不良预后相关。类似地,本研究队列中71%(29/41)的EGFR扩增胃癌患者存在54个其他癌症相关基因的共扩增。此外,一项针对CRC的2期研究表明,初始应答后出现获得性耐药的患者,再次使用西妥昔单抗联合免疫检查点抑制剂(ICI)可能有效;另有1例EGFR扩增、PD-L1阳性的胃癌患者,经西妥昔单抗联合ICI治疗后达到完全缓解。
本研究具有多项优势:首先,通过泛癌种NGS分析明确了EGFR变异的分布特征和详细基因组变异,深化了对EGFR变异的认知;尽管为单中心研究,但基于真实世界数据的队列规模在同类研究中处于领先水平。其次,明确了与EGFR变异相关的癌症相关基因变异类型及频率,为临床医生使用EGFR抑制剂提供了参考;通过鉴定癌症相关基因的共突变,明确了EGFR下游通路、PI3K通路、RAS通路及JAK/STAT通路的突变频率——具体而言,15%的EGFR扩增患者和25%的EGFR突变患者存在KRAS突变,20%的EGFR突变患者存在与PI3K通路相关的PTEN突变。未来需开展进一步的蛋白质基因组学研究以深入理解EGFR变异。例如近期一项研究发现,与原发肿瘤相比,携带EGFR变异的复发性胶质母细胞瘤中EGFR蛋白表达及磷酸化水平降低。
EGFR变异的靶向治疗已取得显著进展,例如用于NSCLC的吉非替尼、厄洛替尼等EGFR TKIs,以及用于CRC的西妥昔单抗,不仅显著改善了患者的临床结局,也推动了耐药机制的相关研究。然而,大多数EGFR变异相关研究仍局限于NSCLC,而6.4%的其他癌症患者存在EGFR变异,相关临床需求尚未得到满足。本研究是目前规模较大的基于NGS的真实世界队列研究之一,拓展了EGFR变异的临床应用场景,为后续相关研究提供了重要的基础数据。
参考文献:
Shin M, Choi DH, Jung J, et al. Epidermal Growth Factor Receptor Aberrations Identified by Next-Generation Sequencing in Patients with Metastatic Cancers. Cancer Res Treat. 2025;57(4):932-941. doi:10.4143/crt.2024.564




