涎腺(唾液腺)肿瘤是罕见且高度异质性的头颈部癌类型。其中,涎腺导管癌(SDC)是侵袭性最强的类型之一,预后较差,且治疗建议有限。SDC中已发现多种可靶向突变,尤其是人表皮生长因子受体2(HER2)突变,据文献报道发生率高达 56%。由于其他癌症中已开发出多种抗HER2治疗方法,因此该靶点备受关注。最后,抗体偶联药物德曲妥珠单抗(T-Dxd)可显著改善无进展生存期和客观缓解率,且副作用可耐受。关于SDC的抗HER2治疗数据较少,主要集中在德曲妥珠单抗,大多数研究描述的是多西他赛或曲妥珠单抗单药治疗。由于SDC患者通常较为年轻且无合并症,他们会接受多种不同的治疗。因此,关于接受德曲妥珠单抗治疗的SDC患者的病例报告有助于促进此类肿瘤的分子检测,并增进临床对这一罕见疾病的认识。本报告描述了一名 44 岁HER2阳性局部晚期SDC男性患者,其在术后不久即出现疾病进展。分子分析显示雄激素受体阳性、MLH1突变及HER2阳性。他接受过多种不同的治疗,包括内分泌治疗、化疗、免疫治疗和抗HER2治疗。德曲妥珠单抗治疗持续时间最长,达 13 个月,期间可同时对局限性进展(颈部淋巴结、骨转移)进行局部治疗。本报告及其他已发表数据强调,对于这一罕见且侵袭性强的涎腺肿瘤,需要更好地落实分子检测建议。此外,这些数据应促进针对这一小患者群体的临床研究发展。
涎腺导管癌的分子特征
涎腺导管癌(SDC)是一种罕见的腮腺肿瘤,约占所有涎腺恶性肿瘤的 5%–10%。在多种不同的涎腺肿瘤亚型中,它被认为是组织学上侵袭性最强的一种。涎腺导管癌常被与乳腺导管癌进行比较,它们具有特定的免疫组织学特征。其中,超过 90% 的患者表达雄激素受体(AR),这使得内分泌治疗可作为一线治疗方案。近期文献表明,7%–56% 的涎腺导管癌对由ERBB2基因编码的人表皮生长因子受体2(HER2)呈免疫组织化学(IHC)染色阳性。HER2是表皮生长因子受体家族的成员,在多种恶性肿瘤中过表达。自 20 世纪 90 年代初针对HER2的单克隆抗体曲妥珠单抗(tz)取得突破性进展以来,抗HER2治疗已获批用于临床,尤其是HER2阳性乳腺癌和胃癌。尽管涎腺导管癌发病率较低,但已有多项试验聚焦于HER阳性涎腺导管癌,并在缓解率和无进展生存期(PFS)方面取得了令人关注的结果。最近,第三代抗HER2药物德曲妥珠单抗(T-Dxd)在乳腺癌和胃癌中显示出令人瞩目的疗效。
关于接受德曲妥珠单抗(T-Dxd)治疗的涎腺导管癌患者,已发表的研究非常少。在Destiny-PanTumor02试验中,共纳入 24 例头颈部癌患者,其中 19 例为涎腺癌。观察到的客观缓解率为 41.7%,12.5% 的患者出现药物相关的间质性肺病或肺炎。另一项I期研究纳入了 8 例HER2过表达的涎腺导管癌患者,显示肿瘤缩小,但细节非常有限;一些病例报告描述了已接受抗HER2治疗(曲妥珠单抗单药治疗、恩美曲妥珠单抗或图卡替尼)的患者出现肿瘤稳定或缓解。然而,仍需要更多真实世界数据来开展临床试验,以期获得如该药物在其他癌症类型中所观察到的显著缓解效果。
病 例
患者男,42 岁,白人,无合并症,因不明原因的突发性右侧面神经麻痹就诊,经类固醇治疗后好转。数日后,面部计算机断层扫描(CT)发现腮腺内钙化性非特异性病变。首次面神经麻痹发作 1 个月后,因临床症状加重,患者接受了右侧腮腺切除术联合同侧颈部淋巴结清扫术。病理分析显示为导管腺癌,29 枚淋巴结中有 10 枚出现肿瘤转移,其中 1 枚存在淋巴结外侵犯(根据美国癌症联合委员会(AJCC)2018 年 1 月版分期标准,分期为T2N3bMx)。术后通过CT扫描和正电子发射断层扫描(PET)评估肿瘤范围,发现右侧颈部淋巴结及至少两处肝转移灶,未见脑转移。补充检测显示,肿瘤过表达雄激素受体(AR,85% 的阳性细胞)和HER2,免疫组织化学(IHC)检测显示 10% 的肿瘤细胞呈强环状膜染色,分类为1+,且经双色双半抗原原位杂交(DISH)检测评分显示扩增(比值为282/66=4.27)。此外,肿瘤错配修复功能正常(pMMR),这一结果经分子生物学检测(微卫星稳定型[MSS])证实。
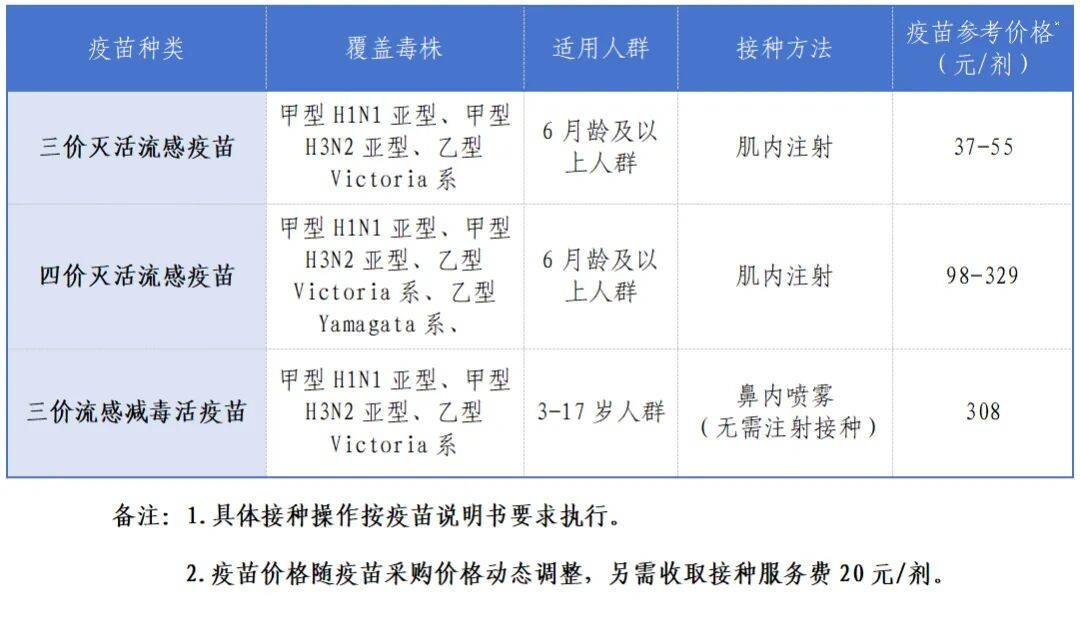
因AR阳性且无临床症状,一线(L1)治疗方案为持续口服比卡鲁胺联合每月注射曲普瑞林。治疗2个月后,通过颈部磁共振成像(MRI)和PET成像评估显示,局部及转移灶进展:颈部淋巴结、皮下病灶、肝转移灶,以及胸骨、骶骨、左侧肋弓、右侧肱骨和C7椎体出现继发性骨转移灶。随后,研究人员开始采用多种治疗方案联合的系统性治疗,仅获得非常有限的部分缓解和/或疾病稳定,治疗持续时间(DT)为 2-6 个月(图1)。二线治疗时,患者接受曲妥珠单抗(tz)联合卡铂+紫杉醇方案,治疗持续时间为 4 个月。值得注意的是,在二线治疗期间,送检样本进行了NGS大panel筛查。结果证实HER2阳性,并显示GRM3突变(p.(R352Q),亚克隆)、TP53突变(p.(G245S))和MLH1突变(p.(R325Q))。由于存在MLH1基因突变,研究人员尝试将患者纳入免疫治疗临床试验,但受COVID-19疫情影响,未能成功。三线治疗(L3)方案为纳武利尤单抗 240 mg,每 2 周 1 次。尽管无神经系统症状,治疗期间仍进行了脑部影像学检查以完善评估。检查发现单个富血管病变,提示可能为神经鞘瘤或转移灶。遗憾的是,首次评估后不久,肿瘤进展持续 3 个月,患者临床状况恶化,继续采用标准化疗联合抗HER2治疗。
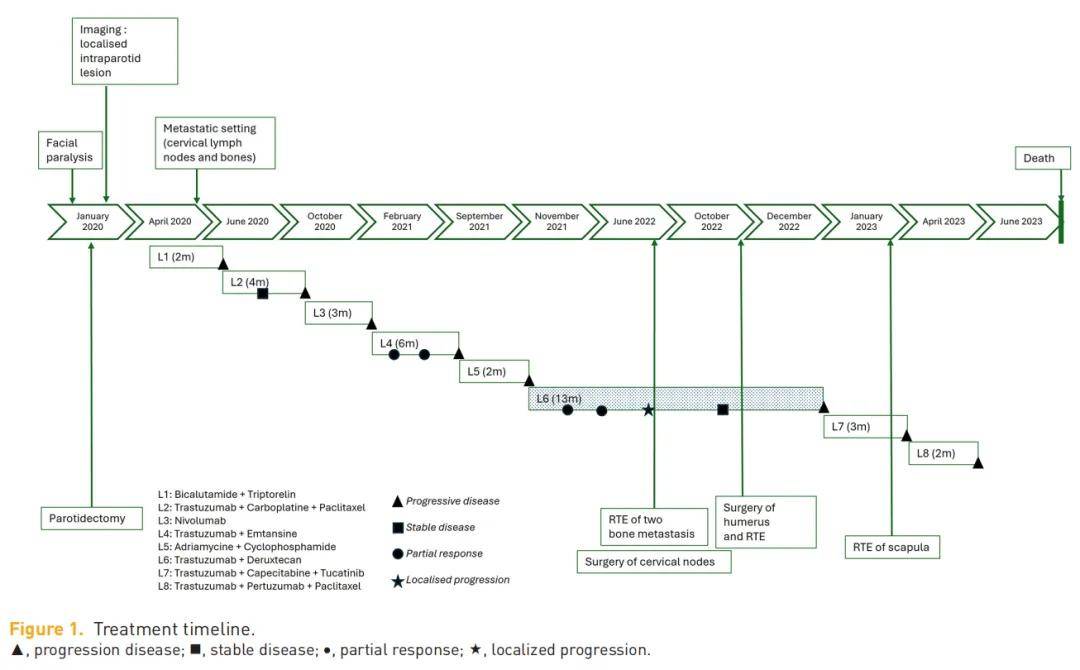
▲图1 治疗时间线
四线治疗为恩美曲妥珠单抗(一种抗体偶联药物,治疗持续时间为 6 个月),随后为阿霉素-环磷酰胺。在接受蒽环类药物联合环磷酰胺治疗(五线治疗)2个月后,PET成像显示右侧锁骨上淋巴结肿大增大,出现肺结节,且骨病变(主要位于右侧肱骨和左侧肩胛骨)的形态代谢增加。确诊转移性疾病 22 个月后,在用尽所有推荐治疗后,疾病再次进展。由于患者东部肿瘤协作组(ECOG)体力状况评分(PS)为1分,状态良好,经本院及全国多学科肿瘤委员会会议(MTBM)批准后,开具德曲妥珠单抗作为六线治疗方案(L6;图2)。已告知患者,目前尚无关于此用法的有效指南。
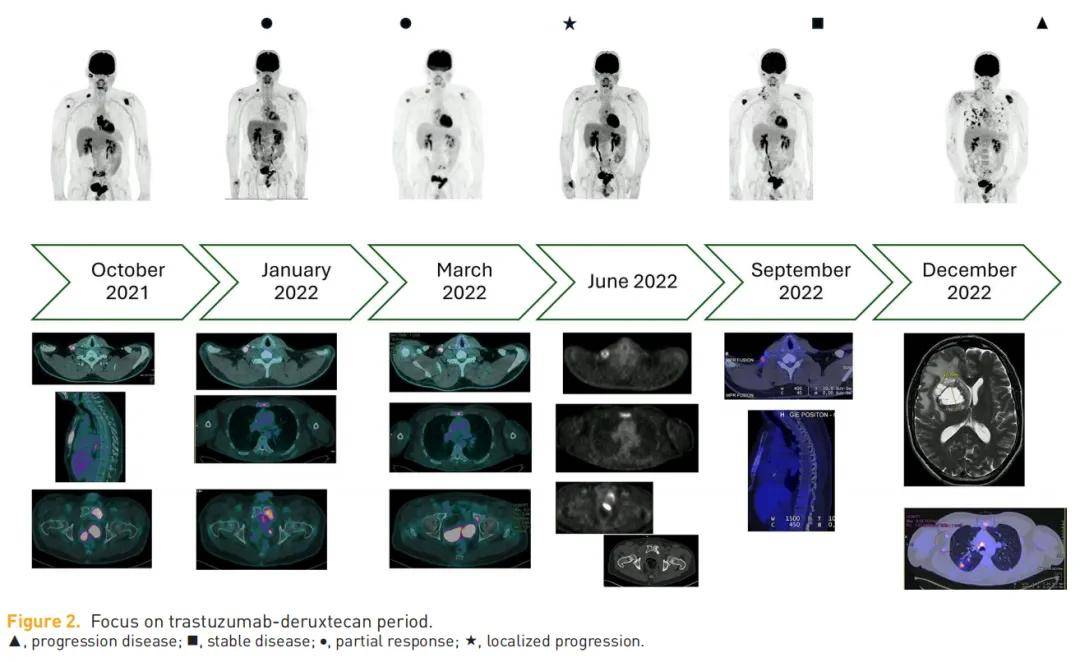
▲图2 重点关注德曲妥珠单抗治疗期间
2021 年 11 月 4 日进行了首次德曲妥珠单抗注射,患者具有良好的临床和生物学耐受性。四次注射后,PET成像显示部分缓解,右侧腮腺原发灶高代谢、已知的继发性骨病变以及肺结节均出现部分消退。右侧锁骨上淋巴结肿大保持稳定,未出现新发高代谢病灶。七次注射后,后续评估发现右侧腮腺区域高代谢几乎完全消退,其余淋巴结和骨病变总体稳定(图1和图2)。遗憾的是,2022 年 6 月,在接受 11 次德曲妥珠单抗注射后(缓解持续时间为 5 个月),PET成像证实右侧锁骨上淋巴结肿大、右侧颈内静脉颈动脉淋巴结以及胸骨和骶骨的骨病灶进展。未出现其他病灶增大或新发灶,无进展生存期(PFS)为 8 个月。多学科肿瘤委员会会议(MTBM)决定,由于无威胁性/症状性病变且耐受性良好,继续使用德曲妥珠单抗,并对孤立进展病灶进行局部治疗:手术切除右侧锁骨上淋巴结肿大,对胸骨和骶骨的骨转移灶进行放疗(每处 30 Gy,分 10 次),同时继续使用德曲妥珠单抗。切除标本的病理分析显示 7 枚淋巴结,其中 5 枚存在淋巴结外侵犯,HER2免疫组织化学(IHC)评分为 1+,荧光原位杂交(FISH)检测显示扩增(图3(a))。

▲图3 病理评估
2022 年 9 月,PET成像显示骨放疗区域完全缓解,右侧锁骨上区存在明显炎症。患者东部肿瘤协作组体力状况评分(ECOG-PS)仍为 1 分,生物学指标良好,无血细胞减少,仅存在治疗引起的 1 级细胞溶解,因此研究人员继续使用德曲妥珠单抗治疗。10 月患者出现右肩严重疼痛,影像学检查证实病理性肱骨骨折(9 月PET成像可见骨转移灶,但当时无症状)。患者接受肱骨病灶髓内钉固定术,随后进行术中放疗(30 Gy,分 10 次)。该骨转移灶的分析证实为已知的细胞类型,并显示HER2免疫组织化学(IHC)评分为 1+(图3b)。德曲妥珠单抗治疗继续进行,未出现不良事件,尤其是无肺部疾病。遗憾的是,2023 年 1 月,在治疗 13 个月后,影像学检查发现已知转移灶和新发部位(主要是脑和肺)出现显著进展。脑部MRI证实至少存在两处脑部病灶,最大者直径 41 mm,对脑室产生占位效应,并伴有中线偏移,导致无法进行放疗(图2)。患者出现精神运动迟缓,伴轻度意识模糊,东部肿瘤协作组体力状况评分(ECOG-PS)为 2 分。应患者要求,尝试了另外两线治疗(曲妥珠单抗-卡培他滨-图卡替尼,治疗持续时间 3 个月;随后为曲妥珠单抗-帕妥珠单抗-紫杉醇,治疗持续时间 2 个月),但均未成功。患者于 2023 年 6 月去世,即停用德曲妥珠单抗后 6 个月,总生存期为 40 个月(图1)。
讨 论
本病例报告显示,这位 44 岁HER2阳性涎腺导管癌(SDC)男性患者使用德曲妥珠单抗(T-Dxd)的治疗持续时间(DT)为 13 个月。其他治疗(内分泌治疗、化疗和免疫治疗)无论是否联合抗HER2治疗(曲妥珠单抗单药、恩美曲妥珠单抗和拉帕替尼),治疗持续时间(DT)仅为 2-6 个月。本病例报告表明,在德曲妥珠单抗治疗期间可进行局部治疗(手术或放疗),且能维持良好的生活质量。
对比文献中的病例具有一定意义(表1)。本文患者比已发表文献中描述的患者更年轻,且在使用德曲妥珠单抗之前接受过抗HER2治疗:曲妥珠单抗单药和恩美曲妥珠单抗。这与其他病例报告相似,这些病例中的患者均接受了多种抗HER2方案治疗;其中 1 例患者接受了图卡替尼治疗。与Boey等人的病例报告中脑转移灶在使用德曲妥珠单抗后缩小不同,本文患者在德曲妥珠单抗治疗期间脑转移灶似乎增大并出现症状。

▲表1 文献中关于使用德曲妥珠单抗治疗涎腺导管癌的患者和治疗特征
本病例报告显示治疗持续时间(DT)长达 13 个月,若能从其他病例报告中获取最新数据,对比德曲妥珠单抗(T-Dxd)治疗结束时及之后的病情进展情况(即何种治疗对应何种肿瘤进展),将具有重要意义。
在已发表的文献中,研究人员观察到不同抗HER2治疗方案有少数长期缓解案例:Shukla等人的研究中,恩美曲妥珠单抗治疗持续 10 个月;Gazola等人的研究中,曲妥珠单抗-图卡替尼-卡培他滨治疗持续 12 个月。文献中关于德曲妥珠单抗用于此类罕见肿瘤的数据非常有限。Takahashi等人的汇总分析纳入了 17 例接受德曲妥珠单抗治疗的涎腺癌患者,其中 9 例为涎腺导管癌,2 例为腺癌。中位缓解持续时间为 17.6 个月,客观缓解率为 58.8%。MYTHOS试验(临床试验注册号:jRCT2011210017)的研究结果已在 2024 年欧洲肿瘤内科学会(ESMO)年会上以海报和口头报告形式呈现,该试验纳入 19 例患者,无进展生存期(PFS)为 15.9 个月(95%置信区间[CI]:5.8–未达到)。在Haigh等人的研究中,作者总结了涎腺癌中抗HER2治疗的应用情况,发现恩美曲妥珠单抗是主要使用的治疗方案。该回顾性队列中,仅 1 例患者接受了德曲妥珠单抗治疗,结果不佳,治疗持续时间为 0.7 个月;该患者接受恩美曲妥珠单抗治疗时应答也不佳(1.5 个月),表明其对抗HER治疗敏感性低。在Meric-Bernstam等人的研究中,HER2表达阳性头颈部癌患者接受了德曲妥珠单抗治疗。HER2免疫组化(IHC)3+组的客观缓解率为 57.1%,而HER2 IHC 2+组和0组分别为 16.7% 和 25.0%。IHC 3+组的无进展生存期和缓解持续时间也优于IHC 2+组(分别为 23.4 个月 vs 7.1 个月和 22.1个月 vs 2.8 个月)。
对患者病程不同阶段HER2状态的分析显示,尽管接受了多种抗HER2治疗并由此产生选择压力,HER2阳性仍得以维持。这一参数值得关注,因为在乳腺癌中,抗HER2治疗后常观察到HER2表达变化。例如,在一项纳入超过 21,000 例初始为HER2过表达乳腺癌患者的研究中,新辅助抗HER2治疗后,21.4% 的病例出现HER2阳性丢失。
目前有多项德曲妥珠单抗早期临床试验正在进行中,主要针对早期和晚期实体瘤。专门针对涎腺癌的研究较少(表2)。其中部分研究将测试德曲妥珠单抗单药治疗,其他研究将尝试联合抗共济失调毛细血管扩张症和Rad3相关蛋白(ATR)、抗HER3或双特异性抗体治疗。

▲表2 正在进行的在晚期/转移性患者中测试德曲妥珠单抗的临床试验
尽管数据仍缺乏,但对涎腺导管癌(SDC)患者进行HER2检测似乎至关重要,这一点已在欧洲肿瘤内科学会(ESMO)临床实践指南(ESMO分子靶点临床可操作性评分II-B级)和美国国家综合癌症网络(NCCN)2025 年v2版指南中得到推荐。得益于有效的、经过验证的靶向治疗,这些简单、廉价的检测如今已在乳腺癌和胃癌中大规模常规开展。
在文献报道的病例中,许多患者通过某种抗HER2治疗可获得约 1 年的缓解时间,且毒性可接受,这对于这些多线治疗患者而言绝非易事。这一策略尤为重要,因为涎腺导管癌患者确诊时的平均年龄约为 65 岁,无明显吸烟或饮酒史,因此总体状况良好。由于美国食品药品监督管理局已加速批准德曲妥珠单抗(T-Dxd)用于不可切除或转移性HER2阳性实体瘤,因此研究人员能够用其治疗涎腺导管癌患者,并改善患者生活质量和生存期。
结 论
总之,需要进一步研究以更好地明确最可能支持HER2阳性并对抗HER2治疗产生良好应答的组织分子特征。在现有的全部抗HER2药物中,鉴于在其他抗HER2治疗后观察到的良好应答,德曲妥珠单抗(T-Dxd)似乎占有一席之地。或许需要在本文患者整个病程中持续抑制HER2受体,正如在HER2扩增的乳腺癌和胃癌中所做的一样。
实体瘤1299基因检测(NGS方法学)项目,可覆盖文中HER2、GRM3、TP53、MLH1、AR等相关基因全编码区(CDS),预测可能获益的靶向、免疫、化疗等治疗方案,同时辅助遗传风险评估。HER2基因扩增检测(FISH方法学)、HER2蛋白表达检测(IHC方法学)、AR表达检测(IHC方法学)也可助力临床精准诊疗。
基因
参考文献:
Evrard C, Goujon J-M, Villalva C, Bainaud M. Trastuzumab-deruxtecan shows interesting disease control in a multitreated patient with ERBB2 amplified parotid carcinoma, a case report. Therapeutic Advances in Medical Oncology. 2025;17. doi:10.1177/17588359251334071