在低分化肿瘤的诊断检查中,T细胞受体(TCR)克隆性长期以来被视为T细胞淋巴瘤的证据。MET外显子14跳跃突变(MET ex14)是肺腺癌中常见的一种突变。本文首次报告一例伴有孤立性单克隆TCRγ基因重排的MET ex14肺腺癌病例。一名 69 岁女性因胸腔积液就诊于外院。胸膜剥脱术标本显示恶性细胞CD30和CD138阳性,但BerEP4、KRT5和EMA阴性。HHV8染色结果模棱两可,却被解读为阳性,导致外院错误诊断为原发性渗出性淋巴瘤。研究人员进一步检查显示,患者无HHV8和T细胞标志物表达,但存在TCRγ克隆性、泛角蛋白及TTF1表达。对活检标本重复进行TCRγ检测,结果显示克隆性阴性。下一代测序检测到MET ex14突变,证实了肺腺癌的诊断。本文讨论了潜在的诊断陷阱及预后/预测意义。
背 景
根据《全球癌症统计》,肺癌目前是第二常见的确诊癌症,仍是癌症死亡的首要原因,估计 2020 年死亡病例达 180 万。腺癌是肺癌最主要的组织学亚型,存在多种可靶向突变,需优先进行分子检测。MET外显子14跳跃突变(MET ex14)在非小细胞肺癌患者中发生率约为 3%-4%,通常不伴随其他驱动突变。美国食品药品监督管理局近期批准卡马替尼和特泊替尼用于转移性MET ex14肺癌患者,这使得MET ex14的识别对患者诊疗至关重要。
通常,肺癌的诊断通过组织形态学评估确立。在处理低分化肿瘤时,组织学分类可能具有挑战性,鉴别诊断范围广泛,包括癌、淋巴瘤等。从分子病理学角度来看,单克隆T细胞受体(TCR)基因排列的存在意味着T细胞的单克隆扩增。尽管人们普遍认为TCR克隆性在多种反应性场景中偶有出现,但对于低分化恶性肿瘤,检测到单克隆TCR基因重排传统上被视为T细胞淋巴瘤的指征。本文首次报告一例伴有孤立性单克隆TCR基因重排的MET ex14肺腺癌病例。
病 例
患者女,69 岁,最初因轻度气短、劳力性呼吸困难及胸部压迫感持续一周以上就诊于外院。患者否认吸烟史。计算机断层扫描(CT)显示其左侧大量胸腔积液,胸膜病变最大达 4.7 cm。胸水细胞学检查阴性。随后她接受了胸膜剥脱术,基于报告的HHV8免疫染色阳性,被诊断为原发性渗出性淋巴瘤(PEL)。患者因担心生活质量下降且无明显症状,拒绝系统化疗。十个月后,患者因疾病进展转诊至美国加州大学圣地亚哥分校病理学和实验室医学系。复查外院标本可见大片大单核细胞,偶见多核细胞,核偏位(图1a、b);这些细胞部分CD30(图1c)、MYC及CD138阳性,但ALK、B细胞标记物(BCL6、CD10、CD19、CD20、CD79a及PAX5)、T细胞标记物(BCL2、CD2、CD3、CD4、CD5、CD7、CD43及TIA-1)、上皮标记物(BerEP4、KRT5及EMA)、间皮标记物(钙视网膜蛋白)、肺标记物(Napsin A)、甲状腺标记物(甲状腺球蛋白)、黑色素细胞标记物(S100及SOX10)及组织细胞标记物(CD68)均阴性。背景淋巴细胞较小,多数CD3阳性(图1d)。鉴于外院HHV8免疫组化结果模棱两可,研究人员再次染色,结果显示阴性。因细胞形态呈间变特征,对外院胸膜剥脱标本组织块行聚合酶链反应(PCR)检测T细胞受体(TCR)重排,发现单克隆TCRγ重排(图2a)。尽管"null型"ALK阴性间变大细胞淋巴瘤(ALCL)在诊断考虑范围内,但进一步检查显示异常细胞部分泛角蛋白阳性(抗体组合包括AE1/AE3、CAM5.2及MNF116,图1e),局灶甲状腺转录因子1(TTF1)阳性(图1f)。此时鉴别诊断包括:伴有单克隆TCRγ重排的肺腺癌与伴有异常局灶性泛角蛋白及TTF1表达的ALK阴性ALCL。

▲图1 肿瘤组织学和免疫组化结果
为明确诊断,3 周后进行了第二次活检,结果显示相似的形态学及免疫表型。补充免疫染色显示KRT7和MOC31阴性。令人意外的是,第二次活检的重复检测未发现单克隆TCRγ重排;毛细管电泳显示峰的数量和高度表明DNA数量/质量充足且扩增成功,排除了假阴性可能(图2b)。为获取更多证据,对外院胸膜剥脱标本进行了下一代测序(NGS)。基于杂交捕获的血液系统恶性肿瘤突变panel检测到致病性TP53突变(p.R213*),变异丰度(VAF)为 12%,以及POT1基因的临床意义未明变异(p.G108V),VAF为42%。实体瘤突变panel检测到MET外显子14跳跃突变(NM_000245.2:c.2888-17_2902del,p.963_1010splice)。DNA测序显示,这是一个以第14外显子5′端为中心、涉及剪接位点的32碱基对缺失,提示MET外显子14跳跃(图2c)。RNA测序显示,部分第15外显子的读段左侧带有第13外显子序列,证实存在MET外显子14跳跃(图2d)。检测到的其他基因变异包括相同的TP53突变(p.R213*),VAF相似(14%),以及NSD1基因的临床意义未明变异(p.S1782C),VAF为 10%。最终确诊为MET外显子14跳跃突变型肺腺癌。骨髓活检未发现肿瘤累及证据。患者再次拒绝全身化疗。
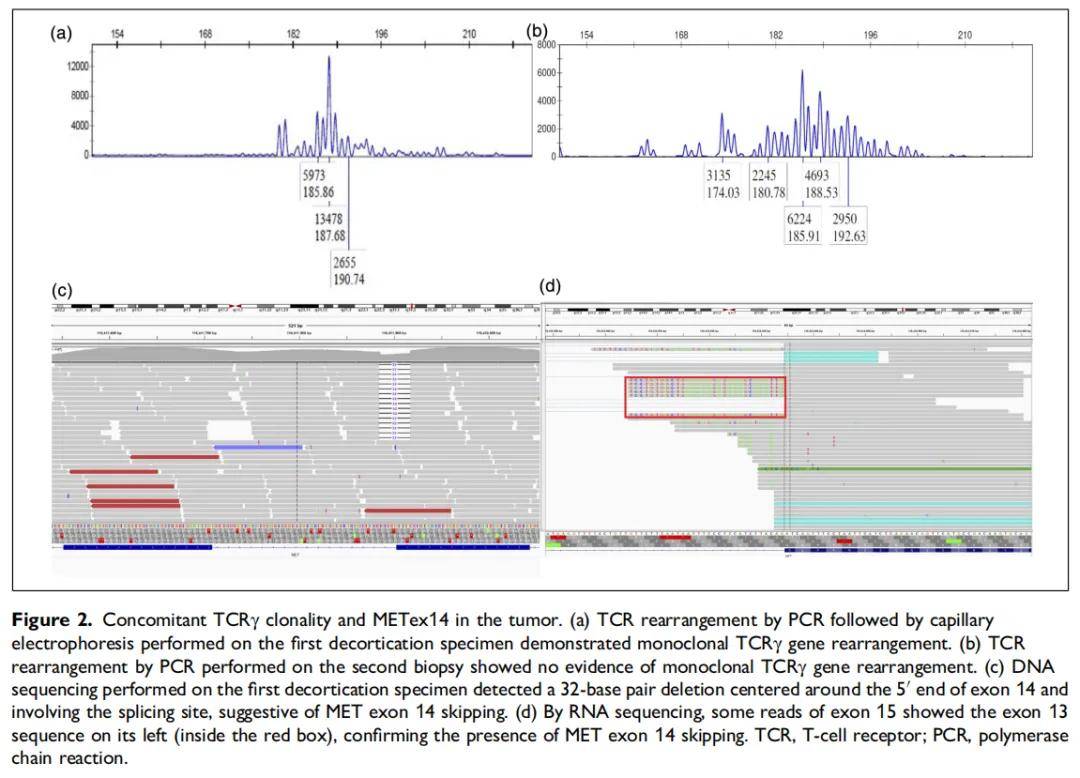
▲图2 肿瘤中TCRγ克隆性与MET ex14的共存
随访CT扫描再次显示左侧胸膜来源的不均匀强化肿块,大小增至 7.3 cm,伴广泛淋巴结肿大(图3a、b)。两周后,患者出现胸痛及左肢麻木。CT扫描发现T3至T5节段新出现 4.4 cm病变压迫脊髓(图3c)。遂行T3-T6椎板切除术及肿瘤减瘤术。标本显示相似的肿瘤形态学及免疫表型。流式细胞术报告T淋巴细胞占 5.5%,CD4:CD8比值降至 1:1,但泛T细胞抗原表达无异常。患者不幸在椎板切除术后 5 周、首次就诊后 13 个月去世。
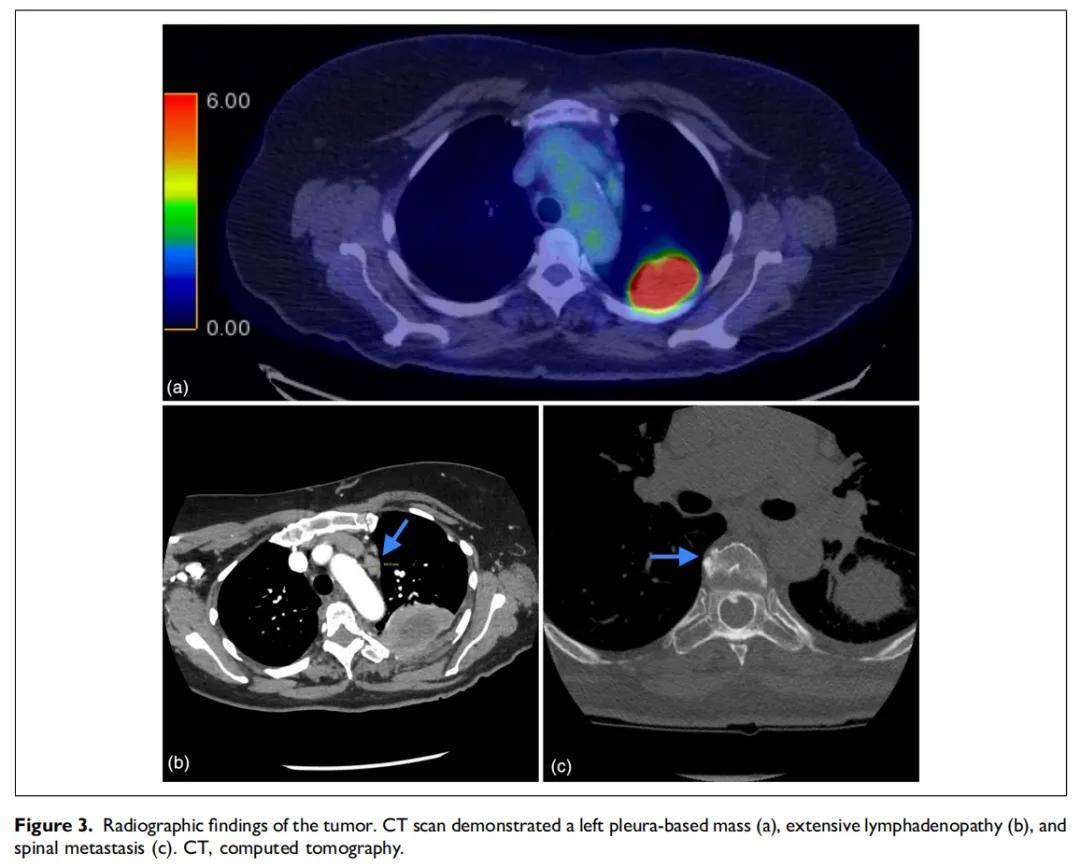
▲图3 肿瘤影像学结果
讨 论
该肿瘤的诊断具有挑战性,最初倾向于淋巴瘤的原因有多种,包括就诊时影像学显示大量胸腔积液为主、低分化/间变形态、CD30阳性、多种上皮标志物表达缺失,以及最重要的是首次胸膜剥脱标本中存在单克隆TCRγ重排。虽然大多数原发性渗出性淋巴瘤(PEL)患者免疫功能低下,但PEL也可罕见发生于免疫功能正常的患者。然而,根据定义,PEL是人类疱疹病毒8型(HHV8)阳性的。间变大细胞淋巴瘤(ALCL)是一种CD30阳性的T细胞淋巴瘤,具有特征性“标志性”细胞。尽管罕见,原发性肺ALCL已有报道[2]。ALCL可能表现为T细胞抗原缺失,即所谓的裸细胞表型。值得一提的是,CD30并非淋巴瘤独有,也可在非血液系统肿瘤中表达。
研究人员进一步检查显示肿瘤泛角蛋白和甲状腺转录因子1(TTF1)阳性。尽管表达呈局灶性,但该免疫表型通常与癌相关,需注意淋巴瘤可能出现角蛋白或TTF1的异常表达。鉴于存在TCRγ单克隆性,研究人员进行了进一步研究。下一代测序(NGS)检测到MET外显子14跳跃突变(MET ex14),但未发现提示淋巴瘤的基因变异。迄今为止,METex14突变几乎仅在肺癌中报道,主要是肺腺癌,仅一例胃腺癌细胞系除外。基于上述一系列发现最终确诊为肺腺癌。
虽然众所周知,TCR单克隆性在慢性炎症状态中罕见发生,但其在实体瘤中的出现尚未被广泛认识。尽管如此,肿瘤浸润淋巴细胞(TILs)的单克隆T细胞反应已在包括肝细胞癌和黑色素瘤在内的实体瘤中有超过三十年的记录。如预期所示,在包括肺腺癌在内的大多数癌症中,TILs的多样性与肿瘤突变负荷呈正相关。最近,特异性TCR重排被发现与EGFR突变型肺癌中的基因改变相关。直观地说,METex14驱动的肺腺癌中有限的新抗原表达可能解释了TILs的单克隆扩增及其导致的TCR单克隆性。尽管据研究人员所知,MET ex14驱动的肺癌中的TCR单克隆性尚未在英文文献中报道,但由于实体瘤中不常规评估TCR克隆性,这一现象可能未被充分认识。需要大样本系列研究才能得出结论。
有趣的是,在本文患者的第二次活检中重复检测TCR重排未显示单克隆性证据。研究人员考虑了首次胸膜剥脱标本中的假阳性和/或第二次活检中的假阴性的可能性。然而,通过组织学检查,两个标本中TILs的丰度似乎相似,提示DNA投入量相仿。在毛细管电泳中,两次TCR检测的峰数量和高度均表明DNA数量/质量充足且扩增成功,排除了假阳性/阴性的可能性。因此,首次标本中存在TCR单克隆性而第二次标本中无此现象的发现,可能代表TCR的空间或时间异质性。
TCR克隆性的空间或瘤内异质性已被独立研究团队在非肿瘤性和肿瘤性场景中充分证实。早在 1996 年,Straten等人比较了同一黑色素瘤不同区域肿瘤浸润淋巴细胞(TILs)中的克隆性T细胞反应,发现在所有受检肿瘤中存在显著的区域差异。Reuben等人对 11 例手术切除的肺腺癌不同区域进行了TCR测序,观察到T细胞密度和克隆性存在显著的瘤内异质性,大多数T细胞克隆局限于单个肿瘤区域。这些结果进一步表明,T细胞的空间差异可能由不同肿瘤区域的不同新抗原驱动。
通过对 72 例非小细胞肺癌患者的 220 个肿瘤区域进行TCR测序,Joshi等人支持了先前关于TCR空间异质性的观察结果,并进一步证实该现象反映了肺癌的突变图谱。Regauer等人提出,在非淋巴瘤场景中局灶性检测到单克隆TCRγ重排是由于单个克隆隐藏在混合浸润中,而非淋巴瘤中的真正单克隆增殖,这是TCR克隆性空间异质性的另一种解释。与空间异质性相比,TCR的时间异质性很少被报道,除非在化疗后或免疫治疗后的情况下,此时TCR的异质性继发于治疗。Baker等人在 15 例转移性结直肠癌患者中追踪了T细胞克隆的时空动态。该研究再次证实了高水平的瘤内空间异质性。值得注意的是,在原发肿瘤、肺转移灶和肝转移灶之间,T细胞克隆数量或TCR克隆性未检测到显著差异,这表明不存在时间异质性。
对于本文患者而言,首次胸膜剥脱术是唯一采集多块组织标本的时间点。遗憾的是,由于无法从外院获取更多标本,无法评估TCR空间异质性的可能性。基于上述现有认知、患者相对较短的临床病程、未接受过化疗/免疫治疗,以及缺乏肿瘤演进的组织学证据,TCR时间异质性被认为可能性较低。然而,鉴于可用数据有限,两种可能性均无法证实或排除。
作为肿瘤微环境的重要组成部分,肿瘤浸润淋巴细胞(TILs)的TCR反映免疫应答效能,尤其与肿瘤逃逸和免疫治疗相关。因此,实体瘤中的TCR可能兼具预后和预测意义。预后方面,多数研究表明高TCR多样性通常与良好预后相关。本文患者的侵袭性临床病程与这些发现一致。治疗方面,特定TCR变异已被证明可预测吉非替尼(gefitinib)对EGFR突变型非小细胞肺癌患者的获益;TCR检测也已成为免疫治疗反应的潜在预测生物标志物。
总之,本文首次报道了伴孤立性TCR单克隆性的MET外显子14跳跃突变(MET ex14)肺腺癌病例。本报告强调了在评估低分化肿瘤时使用TCR克隆性研究的潜在诊断陷阱,即检测到单克隆TCR重排不一定提示T细胞淋巴瘤。对于诊断困难的肿瘤,可考虑重复TCR检测,因为TCR克隆性结果的异质性更支持非淋巴源性。最后,在靶向治疗和免疫治疗时代,理解实体瘤中TCR的预后和预测意义至关重要。
实体瘤1299基因检测、实体瘤272基因检测PLUS、肺癌126基因检测、肺癌76基因检测、肺癌56基因检测、肺癌18基因检测、肺癌11基因检测(NGS方法学)均可检测MET ex14跳突,助力肺癌患者精准诊疗。此外,TCR重排检测(PCR+毛细管电泳基因扫描法)也可助力临床精准诊疗。
参考文献:
Shi WJ, Nguyen J, Song W, Wang HY, Lin GY, Fadare O, Lei L. Isolated Monoclonal T-Cell Receptor Gene Rearrangement in a Lung Adenocarcinoma Harboring MET Exon 14 Skipping: Diagnostic Pitfall. Int J Surg Pathol. 2025 Apr;33(2):484-489. doi: 10.1177/10668969241266927. Epub 2024 Aug 18. PMID: 39155593.





