双相型乳头状肾细胞癌(BPRCC)是一种新近认识的罕见肾细胞癌亚型,其特征为双相形态学和独特的免疫表型特征。既往被认为是经典型乳头状肾细胞癌的一个亚型,其临床病理和分子特征仍研究不足。本文分析了 10 例BPRCC的组织学、免疫表型、分子及临床特征。该队列包括 7 名男性和 3 名女性(中位年龄 48 岁),肿瘤大小为 25-45 mm,均为pT1期。中位随访 55 个月期间,未观察到疾病进展或癌症相关死亡。组织学上,所有肿瘤均呈双相结构,含有不同比例的大嗜酸性鳞状细胞和小嗜碱性细胞。1 例肿瘤表现出局灶性横纹肌样特征。免疫染色显示PAX8、CK7、AMACR和Claudin4均弥漫阳性。两种细胞群在Cyclin D1、AMACR、高分子量角蛋白(K903)、E-钙粘蛋白和Ki-67的表达上存在差异。所有肿瘤GATA3、p63和CAIX均阴性(2 例局灶阳性),p53、RB1和错配修复蛋白表达正常。荧光原位杂交(FISH)证实所有肿瘤均存在 7 号和 17 号染色体三体。靶向二代测序(NGS)显示MET扩增(2 例)、MET突变(1 例)、NOTCH1突变(9 例),以及MAP2K2、FGFR4、DNA损伤修复(DDR)通路基因(如PMS2、CDK12 R44W、RAD51C/D)和染色质重塑基因(EZH2、ARID1A)的改变。这些发现支持BPRCC作为乳头状肾细胞癌的一个独特亚型,具有一致的双相形态学、免疫表型差异,以及富集NOTCH、MAPK和DDR通路改变的独特分子谱。

▲摘自《WHO(2022)泌尿系统和男性生殖器官肿瘤分类》
背 景
乳头状肾细胞癌(PRCC)在历史上基于形态学标准被亚分类为1型和2型,是肾细胞癌的第二常见亚型。然而,越来越多关于重叠特征和独特遗传学特征的证据已导致世界卫生组织(WHO)不再采用严格的二元分类,而是认可由独特的形态学、免疫表型和分子特征定义的更广泛的PRCC亚型谱系。其中,双相型乳头状肾细胞癌(BPRCC),也称为双相型鳞样腺泡状肾细胞癌(BSARCC),最近已成为一种与PRCC密切相关的新型罕见亚型。BPRCC于 2012 年由Petersson等人首次描述,其特征为独特的双相结构,即排列于腺泡状腔隙的小立方细胞和位于中央的较大鳞状细胞。随后Hes等人和Trpkov等人的研究进一步详细描述了其临床病理特征、免疫表型谱和细胞遗传学特征,报告了7号和17号染色体的持续获得以及Y染色体的频繁丢失,进一步证实了其与PRCC的关系。最近,Denize等人证实,MET致癌基因变异可能是双相PRCC的主要致癌驱动因素,强调该亚型中MET突变的频率更高。Nova-Camacho等人进行了靶向二代测序,重点关注致病性MET单核苷酸变异(SNVs),并在 31%(4/13)的病例中检测到MET SNVs。此外,Chartier等人报告了 2 例发生在遗传性PRCC背景下的家族性BPRCC病例,均存在胚系MET突变,进一步支持其与乳头状肾细胞癌的生物学连续性。其他病例报告有助于扩展该肿瘤的形态学和分子谱系。尽管付出了这些努力,但由于双相型乳头状肾细胞癌(BPRCC)的罕见性,其形态学谱系、分子变异及临床病程仍未完全明确。本研究报告了 10 例BPRCC病例,并对其临床病理、免疫组织化学及分子特征(包括靶向二代测序)进行综合分析,以进一步阐明并丰富当前对这一独特肾肿瘤的认识。
TIPS|双相型乳头状肾细胞癌(BPRCC)
乳头状肾细胞癌(papillary renal cell carcinoma,PRCC)是仅次于肾透明细胞癌的第二大常见肾细胞癌,占肾癌的 15%-20%。1997 年,Delahunt和Eble根据癌细胞形态特点将PRCC分为两型,II型比I型预后差。然而,Saleeb等研究发现,多达 50% 的PRCC并不能完全符合上述分型,不同作者给予不同的名称,如嗜酸细胞型、透明细胞型、实性型、Warthin瘤样型等。2012 年Petersoon等首次描述 2 例具有特殊形态特征的肾细胞癌,称为“双相型鳞样腺泡状肾细胞癌(biphasic squamoid alveolar renal cell carcinoma,BSARCC)”。2018 年Trpkov等进一步研究发现,该类型肾癌形态学上并没有真正鳞状分化的证据(无角化或细胞间桥),免疫组化标记鳞状细胞均不表达p63和CK5/6,为避免术语上的混淆,建议将该类型的肾细胞癌命名为双相型乳头状肾细胞癌(biphasic papillary renal cell carcinoma,BPRCC)。BPRCC往往具有PRCC的遗传学特征,表现为7、17号染色体三体或Y染色体缺失。


▲摘自《肾脏双相型乳头状肾细胞癌的临床病例及分子学特征》
研究材料和方法
肿瘤选择和研究设计
本研究通过回顾波士顿医学中心病理科 2010 年至 2024 年的档案,对诊断为乳头状肾细胞癌(PRCC)的肾切除标本进行分析。其中,根据Hes等人和Trpkov等人提出的标准确定了 10 例双相型乳头状肾细胞癌病例。同时收集了 3 例无鳞状细胞成分的经典“1型”乳头状肾细胞癌作为对照病例。收集所有病例的完整肿瘤切片进行组织学复查。每例肿瘤选取 1 个代表性福尔马林固定石蜡包埋(FFPE)肿瘤组织块,用于免疫组织化学分析、荧光原位杂交(FISH)检测及靶向二代测序(NGS)。从患者的电子病历中提取相关临床病理信息,包括患者年龄、性别、肾脏疾病分期、肾癌既往病史和家族史、肿瘤位置、影像学检查结果、手术方式、临床随访及结局。
组织学评估
肿瘤大小根据切除标本的大体检查记录。所有病例均对苏木精-伊红(H&E)染色的肿瘤切片进行全面的组织病理学评估(每例 4 至 15 张肿瘤切片)。核分级根据世界卫生组织(WHO)/国际泌尿病理学会(ISUP)分级系统进行评定。评估的其他组织学参数包括结构、细胞学特征、横纹肌样和/或肉瘤样分化的存在情况、肿瘤坏死及砂粒体。系统评估了其他高级别病理特征,包括肾窦侵犯、肾周脂肪组织侵犯、肾上腺受累、血管及肾静脉侵犯、区域淋巴结转移及手术切缘状态。肿瘤分期根据美国癌症联合委员会(AJCC)第 8 版TNM分期标准确定。
免疫组织化学
免疫组织化学分析在福尔马林固定、石蜡包埋(FFPE)组织切片上进行,使用自动化染色平台及预稀释抗体。抗体组合包括PAX8、CD10、细胞角蛋白CK7、AMACR、Cyclin D1、CAIX、Ki-67、GATA3、高分子量细胞角蛋白(HMWCK)、p63、PIN4、p53、RB1、Claudin4、E-钙黏蛋白、MLH1、PMS2、MSH2和MSH6。所有染色过程均包含适当的内源性阳性对照和阴性对照。基于阳性染色肿瘤细胞的比例对免疫组织化学表达进行半定量评估,采用以下评分标准:阴性(<1%)、1+(1–25%)、2+(26–75%)和3+(>75%)。
FISH和二代测序
共 13 例样本(包括 10 例BPRCC和 3 例经典“1型”PRCC)接受荧光原位杂交(FISH)检测。将 4 μm厚的福尔马林固定石蜡包埋(FFPE)组织切片贴附于带正电荷的载玻片上,根据相应的苏木精-伊红(H&E)染色切片勾勒出目标区域。杂交后洗涤完成,使用适当的滤光片在荧光显微镜下检查圈定区域。非整倍体评分需在 30 个随机选择、无重叠的肿瘤细胞核中计数荧光信号,计算橙信号与绿信号的比值及每个细胞的平均信号数。比值 ≥1.5 且每个细胞平均信号数 >2.0 被认为提示相应染色体存在多倍体。
对 10 例BPRCC肿瘤样本进行靶向二代测序(NGS)。NGS在波士顿医学中心病理科分子诊断实验室进行。在苏木精-伊红(H&E)染色参照切片的指导下,从福尔马林固定石蜡包埋(FFPE)组织中手动切割双相成分富集区域,确保用于分子检测的样本中鳞状肿瘤细胞含量至少为 20%。分析灵敏度阈值定义如下:单核苷酸变异/多核苷酸变异(SNVs/MNVs)和小插入/缺失(indels)的最低变异丰度(VAF)为 5%,扩增的拷贝数变异阈值为 ≥6。
研究结果
临床病理特征
本研究共纳入 10 例双相型乳头状肾细胞癌(BPRCC)病例。该队列由 7 例男性和 3 例女性患者组成(男女比例 2.3:1),中位年龄为 48 岁(平均值为 51 岁,范围 39-67 岁)。其中 4 例为白人/高加索人,6 例为黑人/非洲裔美国人。所有患者均无肾癌既往病史或家族史。2 例患者存在基础肾脏疾病,1 例为慢性肾病,另 1 例为终末期肾病。8 例患者接受肾部分切除术,2 例接受根治性肾切除术。1 例肿瘤(病例10)为多灶性,2 例合并其他亚型肾细胞癌,包括 1 例乳头状肾细胞癌(病例9,异时性)和 1 例透明细胞肾细胞癌(病例3,同时性)。肿瘤中位大小为 34 mm(范围 25-45 mm)。6 例肿瘤位于右肾,4 例位于左肾。所有肿瘤均为低分期,其中 8 例分期为pT1a,2 例为pT1b。所有患者均有随访数据,随访时间为 6-142 个月(中位 55 个月)。随访期间未观察到局部复发、转移或疾病相关死亡。临床病理特征总结见表1。
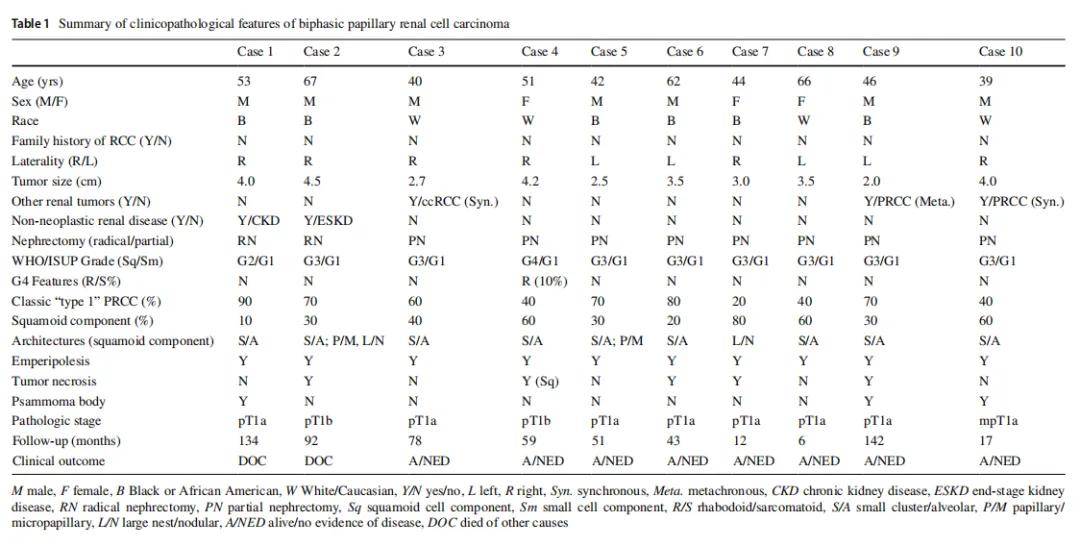
▲表1 双相型乳头状肾细胞癌临床病理特征汇总
组织学特征
大体上,所有双相型乳头状肾细胞癌均表现为实性棕白色外观,伴局灶性出血和/或坏死区域(图1a、b);2 例可见胶冻样变性区域(图1c)。相比之下,经典乳头状肾细胞癌(PRCC)通常质脆、呈棕褐色,出血、坏死及囊性变更为常见(图1d)。组织形态学上,所有肿瘤均以小管乳头状结构为主。所有病例均可见特征性双相形态,由大量鳞状样细胞成分(中位值 = 35%,范围 = 10%-80%)和背景为类似经典“1型”乳头状肾细胞癌的小肿瘤细胞组成(图2a)。与大的鳞状样细胞成分相关的结构模式包括:小簇状或腺泡状结构(10 例中有 9 例,图2a、e、f)、乳头状或微乳头状结构(10 例中有 2 例,图2b、d)以及大巢状或结节状结构(10 例中有 2 例,图2c)。病例22表现为小簇状/腺泡状、乳头状/微乳头状及大巢状/结节状结构的混合模式,病例5肿瘤表现为小簇状/腺泡状与乳头状/微乳头状结构的混合模式。
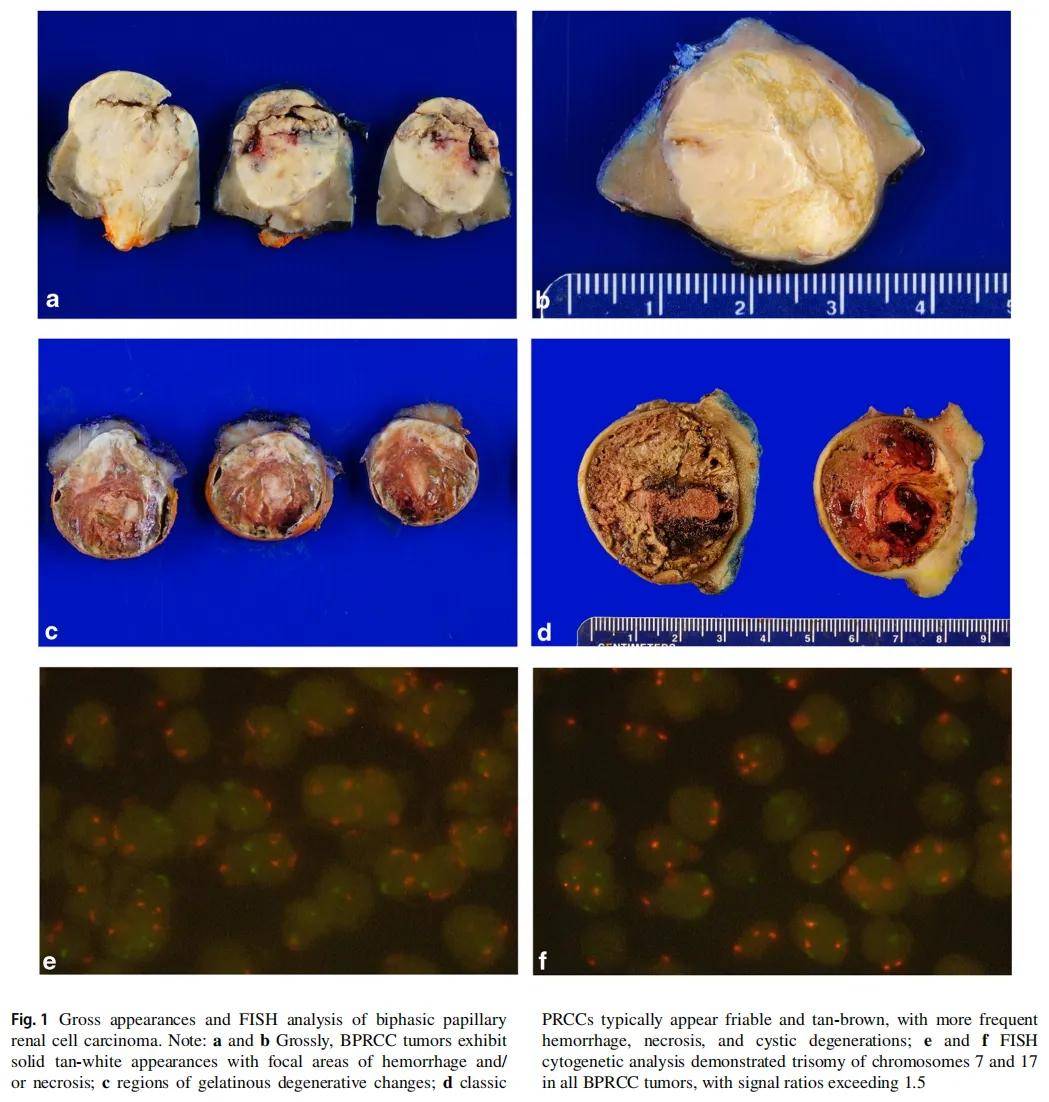
▲图1 双相型乳头状肾细胞癌大体外观和FISH检测结果
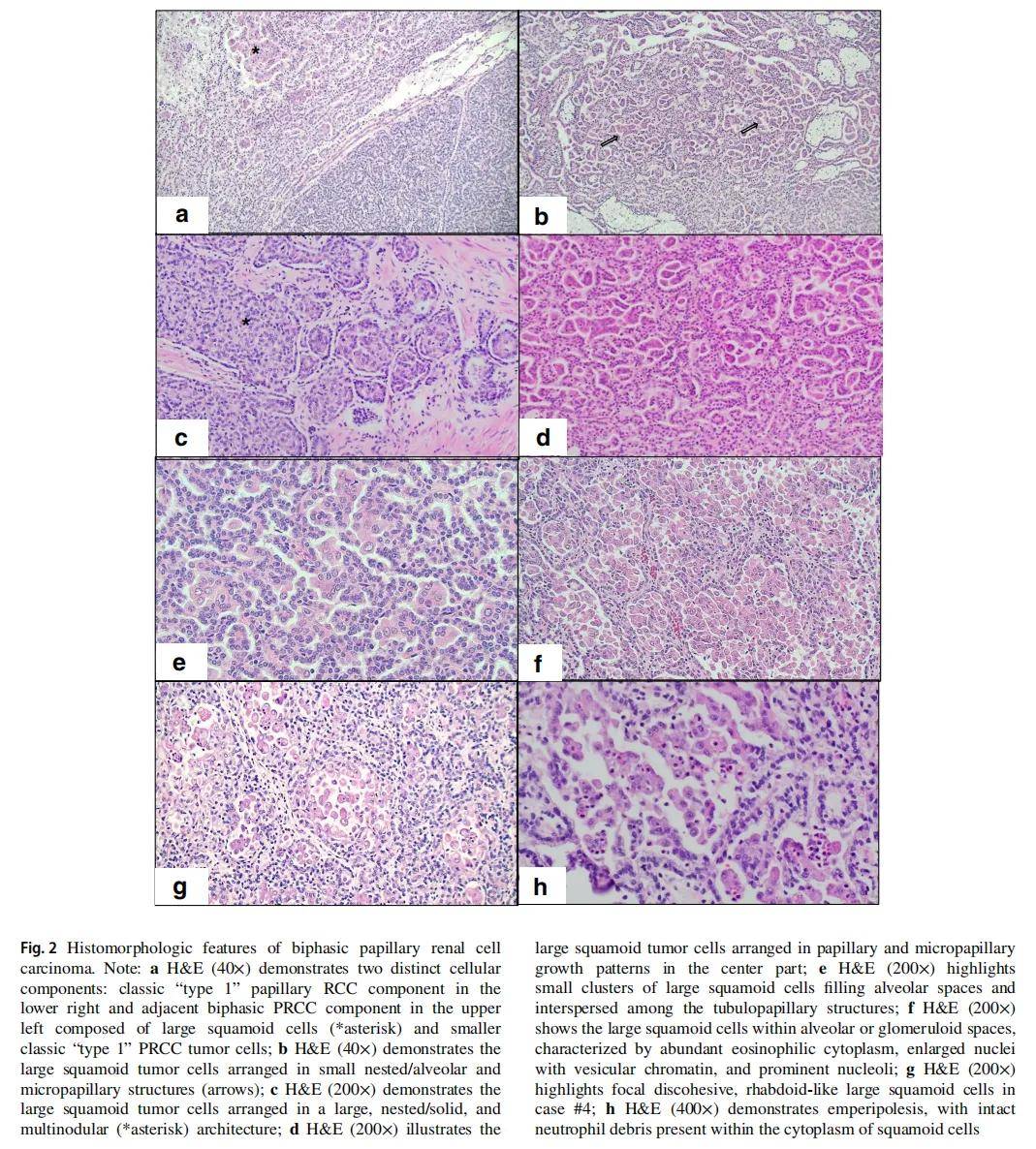
▲图2 双相型乳头状肾细胞癌组织学特征
大的鳞状样细胞通常位于腺泡状或肾小球样间隙内,特征为丰富的嗜酸性胞质、增大的细胞核伴空泡状染色质及明显的核仁。相比之下,小肿瘤细胞表现为嗜双色至透明胞质,小至中等大小的细胞核及不明显的核仁,衬覆于乳头状、腺泡状及肾小球样结构(图2e、f)。值得注意的是,未发现明确的鳞状分化特征,如角质珠或细胞间桥。1 例肿瘤(肿瘤4,图2g)可见局灶性松散的横纹肌样形态,被归类为WHO/ISUP 4级。在其余肿瘤中,基于鳞状样细胞成分中观察到的较高核分级,1 例为2级,8 例为3级。细胞内吞噬现象表现为鳞状样细胞胞质内可见完整的中性粒细胞,在所有病例中均可见(图2h)。5 例可见肿瘤坏死,其中 1 例累及鳞状样细胞。10 例肿瘤中有 3 例可见砂粒体。
免疫组化结果
对 10 例双相PRCC中富集双相成分的肿瘤切片均进行了免疫组化分析(表2)。两种细胞成分(小细胞和大鳞状样细胞)均对PAX8和CK7呈强且弥漫性阳性。相比之下,多种标志物(包括Cyclin D1、AMACR、HMWCK、CD10、E-钙粘蛋白和Ki-67)在两种成分间表现出差异表达。Cyclin D1在所有病例中均标记大鳞状样细胞(10/10,图3a),且这些细胞的Ki-67增殖指数也高于小细胞成分(5-20% vs. 1-5%,图3b)。
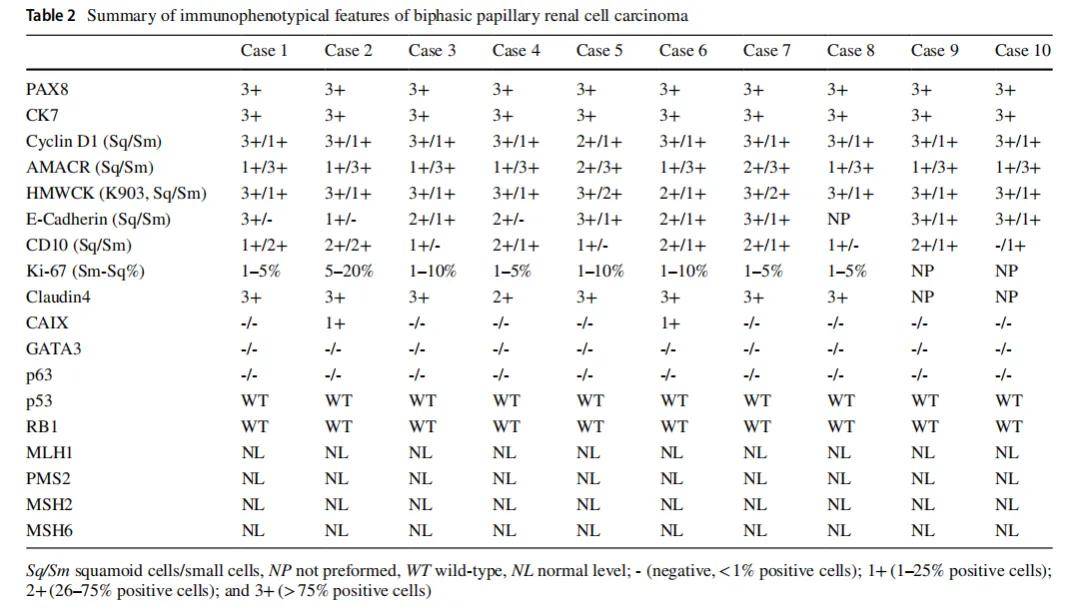
▲表2 双相型乳头状肾细胞癌免疫组化特征汇总
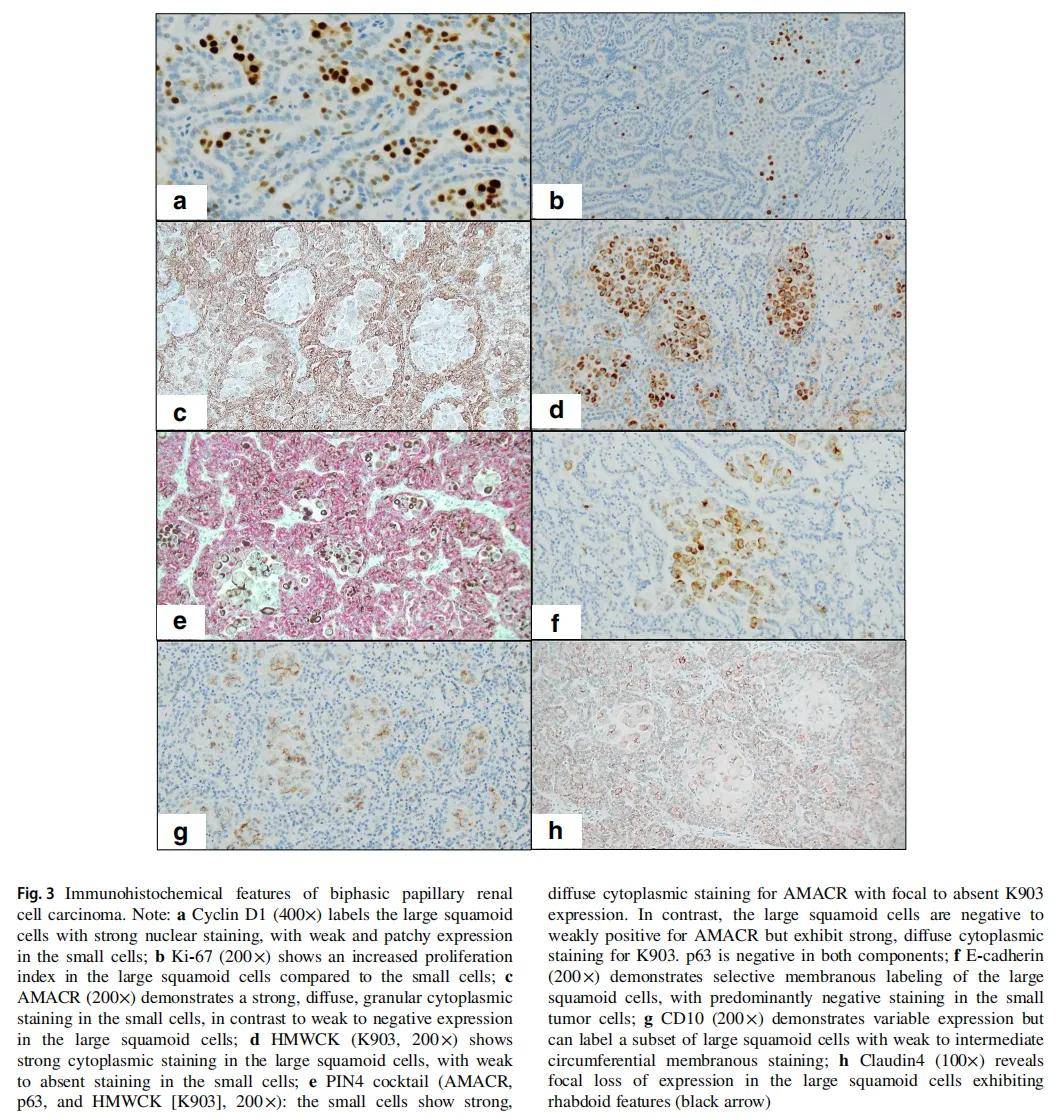
▲图3 双相型乳头状肾细胞癌免疫组化特征
AMACR在小细胞中呈强、弥漫、颗粒状胞质染色,在所有 10 例的大/鳞状样细胞中呈弱至阴性表达(图3c)。相反,HMWCK(K903)在大的鳞状样细胞中表现出更强的染色模式,在小细胞中呈弱至无染色(图3d)。这些发现进一步在图3e中展示,该图显示了PIN4的染色结果。
E-钙粘蛋白在大的鳞状样细胞中保留膜性表达模式,而在小细胞成分中呈阴性至淡染(9/9,图3f)。CD10表现出不同程度的异质性表达。值得注意的是,局灶性顶端膜染色主要见于小细胞亚群,而在大的鳞状样细胞亚群中可见弱至中度环形膜染色(图3g)。Claudin4在10例中的8例中均在两种肿瘤细胞群中表达,仅1例(病例4)在表现出横纹肌样特征的大的鳞状样细胞中可见局灶性表达缺失(图3h)。
所有肿瘤的GATA3、p63和CAIX均呈阴性,仅2例可见局灶性CAIX染色。未发现p53或RB1的异常表达。错配修复蛋白(MLH1、PMS2、MSH2和MSH6)在所有病例中均表现出完整的核表达。免疫组化结果总结见表2。
为进行比较,对 3 例经典“1型”乳头状肾细胞癌(PRCC)进行了选定的免疫组化染色。肿瘤细胞对CK7和AMACR呈弥漫强阳性,对HMWCK(K903)呈局灶性斑片状染色,对Cyclin D1呈单个细胞弱至中度染色。
FISH检测
所有 13 例肿瘤(包括 10 例双相型乳头状肾细胞癌和 3 例经典“1型”乳头状肾细胞癌)均接受了针对7号和17号染色体的荧光原位杂交(FISH)分析。所有病例中均检测到7号和17号染色体三体,信号比值超过 1.5(图1e、f),这与乳头状肾细胞癌(PRCC)中观察到的典型细胞遗传学改变一致。
二代测序检测
10 例双相型乳头状肾细胞癌(BPRCC)肿瘤均接受了靶向下一代测序(NGS),测序区域为富集大鳞状样形态的肿瘤区域。NGS分子分析显示分子改变呈异质性,改变按通路相关性分组。MET变异(包括扩增,病例4和7;突变,病例8)支持其归类为“1型”样乳头状肾细胞癌(PRCC)。10 例中有 9 例检测到NOTCH1突变(p.P498R和/或p.C499F),其中病例2、9和10同时存在NOTCH2NLC R74突变。4 例检测到影响MAPK信号通路的MAP2K2 Q38突变。5 例可见反复出现的FGFR4 G388R突变,该突变与受体酪氨酸激酶激活相关。多个肿瘤中观察到DNA损伤修复基因(PMS2、MSH6、CDK12 R44W、RAD51C/D、BRCA1)的拷贝数增加和TP53扩增,其中病例2和4最显著。2 例中出现染色质重塑基因(EZH2和ARID1A)改变,病例9中检测到抑癌基因FBXW7突变。这些发现突出显示该队列内的分子异质性,存在部分重叠但不完全相同的通路激活模式。表3提供了详细的病例总结。
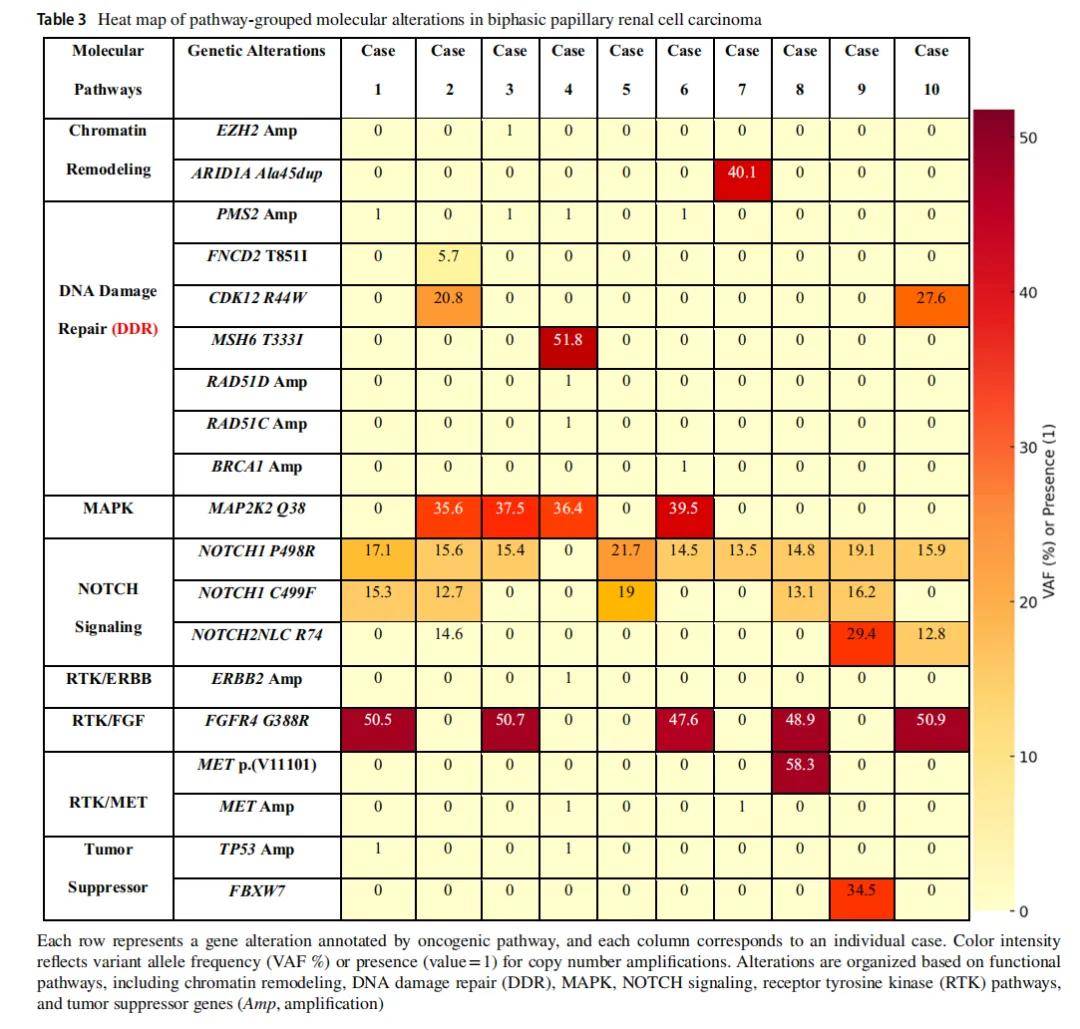
▲表3 双相型乳头状肾细胞癌通路分子变异的热点图
讨 论
本研究报道了双相型乳头状肾细胞癌(BPRCC)的病例系列,整合了临床病理、组织形态学、免疫表型和基因组数据,以加深对这一罕见且近年才被认识的肾肿瘤的理解。本文对 10 例病例的分析构成了迄今为止最全面的评估之一,并强调了其在临床、形态学、免疫表型和分子谱方面的若干特征性表现,支持将BPRCC归类为乳头状肾细胞癌(RCC)谱系中的独特亚型。
临床上,本文队列中的所有BPRCC肿瘤均表现为低病理分期(pT1a-pT1b),且临床行为惰性,随访期间未观察到局部复发、转移或疾病相关死亡。尽管本文所有肿瘤均为低分期,但既往研究已报道具有转移潜能的更高分期BPRCC。1 例肿瘤(病例4)表现出横纹肌样形态,这一特征常与侵袭性行为相关;然而,该患者在 59 个月随访时仍无病生存。BPRCC也有报道与其他肾细胞癌亚型相关,且可表现为多灶性病变。在本文队列中,病例10肿瘤为多灶性,病例3肿瘤合并同侧同时性透明细胞肾细胞癌,1 例患者(病例9)在初始诊断 5 年后发生对侧异时性乳头状肾细胞癌。
本文队列中的肿瘤更常见于较年轻个体,通常在40至50岁之间,中位年龄为48岁。值得注意的是,10 例患者中有 5 例年龄小于 50 岁,其发病年龄比经典乳头状肾细胞癌的典型发病年龄早十余年,后者通常发生于 60-70 岁。既往队列中也描述了早发病例。这些发现提示存在潜在遗传性易感性的可能性。本文的 1 例患者(病例9)接受了胚系基因检测,未发现任何致病性癌症相关变异。然而,Chartier等人先前的研究报道了在遗传性乳头状肾细胞癌背景下的BPRCC,进一步支持部分病例存在遗传基础的可能性。
组织学上,双相型乳头状肾细胞癌的特征是独特的双相结构,由两种形态学上不同的肿瘤细胞群组成。较小的细胞与经典“1型”乳头状肾细胞癌中观察到的细胞高度相似,主要形成小管乳头状和肺泡样结构。相反,大的鳞状样细胞以丰富的嗜酸性胞质、核增大伴明显核仁为特征,通常位于肺泡腔内或散在分布于小管乳头状结构之间。这种特征性双相组织形态学引出了一种假说,即这两种成分可能反映了来源于不同肾单位节段的分化。
为进一步探究这一可能性,研究人员对队列中所有肿瘤进行了免疫表型分析。两种细胞群均显示PAX8和细胞角蛋白7(CK7)的强弥漫性表达,证实其为肾上皮起源。然而,这两种成分表现出不同的免疫谱。大的鳞状样细胞显示强核细胞周期蛋白D1(Cyclin D1)表达、高分子量细胞角蛋白(HMWCK,K903)弥漫性胞质染色、α-甲酰基辅酶A消旋酶(AMACR)灶性胞质染色,以及较高的Ki-67增殖指数。相反,小细胞表现出强弥漫性颗粒状胞质AMACR染色、HMWCK灶性和灶片状表达,以及低Ki-67指数。
这些不同的免疫染色模式与已知的肾单位节段特异性标志物一致。AMACR通常在近曲小管(PCT)中强表达,而在远曲小管(DCT)中仅弱表达或灶性表达。相反,高分子量细胞角蛋白(HMWCK,K903)优先标记肾单位远端节段,包括远曲小管(DCT)、集合管、肾盂、肾盏和输尿管。此外,E-钙粘蛋白(E-cadherin)在远曲小管中高表达,是这些区域的节段特异性标志物。在此背景下,本文的发现支持BPRCC的双细胞分化模型,即小肿瘤细胞表现出近端小管上皮的特征,而大的鳞状样细胞则显示远端肾单位分化的特征,尤其是涉及远曲小管(DCT)。此外,两种成分均不表达GATA3和p63,这反驳了尿路上皮分化的可能性,因为来源于集合系统的肿瘤通常表现出鳞状特征以及这些标志物的阳性免疫反应性。
为进一步评估双相型乳头状肾细胞癌(双相PRCC)与经典“1型”乳头状肾细胞癌(PRCC)之间的区别,研究人员对 3 例经典“1型”PRCC进行了对比免疫组化染色(CK7、AMACR、PIN4、Cyclin D1和Ki-67)。所有病例中,AMACR均呈弥漫性强胞质阳性,标记几乎所有肿瘤细胞,与近端小管分化一致。相反,高分子量细胞角蛋白(HMWCK,K903)染色呈灶性、灶片状或完全阴性,Cyclin D1仅标记散在肿瘤细胞,与任何特定形态学区域无关。这种模式与双相PRCC显著不同,在双相PRCC中,Cyclin D1和HMWCK的表达突出显示双相结构内一个形态学和功能上不同的增殖区域。
综上所述,这些发现支持以下结论:双相型PRCC是经典PRCC在组织学和生物学上独特的亚型,其特征为双相形态学和节段特异性免疫表型特征。值得注意的是,大的鳞状样细胞可能代表具有进一步去分化潜能的高级别成分。病例#4即是例证,其中大细胞群显示灶性横纹肌样细胞形态,伴Claudin4表达缺失,这一发现可能作为识别横纹肌样转化的有用标志物。
经典PRCC公认起源于近曲小管(PCT)。本文对比分析支持这一起源,但也表明经典PRCC可能表现出提示远曲小管(DCT)样分化的灶性特征。相反,双相型PRCC表现出涉及PCT和DCT的真正双相分化,其证据为其独特的形态学、免疫表型和结构分区。这种双节段分化突显了双相型PRCC的独特生物学特性,并支持将其归类为乳头状肾细胞癌谱系中一个独特的形态学亚型。
在分子水平上,荧光原位杂交(FISH)细胞遗传学分析证实所有双相型乳头状肾细胞癌(BPRCC)肿瘤均存在7号和17号染色体三体,这与经典“1型”乳头状肾细胞癌中常见的典型改变一致,癌症基因组图谱(TCGA)研究已对此进行了广泛报道。然而,对BPRCC病例的靶向二代测序(NGS)显示其分子图谱更为复杂且存在通路富集,涉及MET、NOTCH、MAPK和RTK信号通路。反复出现的NOTCH1突变和FGFR4 G388R变异提示该亚型存在独特的致癌驱动因子。此外,部分肿瘤存在DNA损伤修复(DDR)基因的拷贝数增加,同时伴有染色质重塑基因(如EZH2和ARID1A)的突变,提示潜在的基因组不稳定性。病例4体现了这一趋势,其表现出MET、ERBB2和TP53的扩增,同时伴有横纹肌样形态和DDR相关改变,这些特征提示肿瘤进展和去分化。
这些发现与TCGA数据一致,后者表明“1型”乳头状肾细胞癌通常以MET改变为特征,尽管本文队列中MET改变的发生率低于既往BPRCC研究报道。它们也与Murugan等人开展的大型纪念斯隆·凯特琳癌症中心(MSKCC)研究结果一致,该研究揭示乳头状肾细胞癌中的“2型”形态通常代表“1型”肿瘤的形态学变异型或克隆演化,在配对分析中具有共享的分子改变,包括MET、染色质修饰因子和DDR通路基因。
综上所述,这些发现提示双相型乳头状肾细胞癌(BPRCC)存在分子异质性,其特征为与经典“1型”乳头状肾细胞癌(PRCC)相比,具有重叠但可能更复杂的基因组改变和通路激活。尽管部分BPRCC肿瘤具有“1型”PRCC中常见的特征(如MET改变和7号/17号染色体三体),但其他肿瘤表现出涉及NOTCH、MAPK和DNA损伤修复(DDR)通路的基因组改变,而这些在“1型”PRCC中报道较少。这种分子多样性可能反映了BPRCC内部存在生物学上不同的亚型谱系,它们以特征性双相形态为共同特征,但可能由不同的致癌通路驱动。尽管尚未发现明确的驱动突变,但大多数病例中检测到NOTCH突变,其变异丰度通常低于 20%。这些改变在肾肿瘤中的功能影响尚不确定,但其持续存在值得进一步研究。总体而言,这些发现为将BPRCC视为乳头状肾细胞癌谱系中的一个独特实体提供了初步支持。
本研究存在一些局限性,应予以说明。首先,样本量有限,这可能反映了双相型PRCC固有的罕见性和可能的认识不足。其次,尽管靶向二代测序(NGS)为反复出现的基因组改变提供了有价值的见解,但受限于检测panel原因,无法识别更多突变。第三,虽然靶向NGS选择性地在富含鳞状样成分的肿瘤区域进行,从而能够对这一形态学上独特的细胞群进行针对性的分子特征分析,但这种方法可能无法完全反映整个肿瘤的基因组复杂性。结合现有文献解读时,本文发现提供了初步见解,可能有助于BPRCC的识别和分类。然而,仍需开展更大规模的研究,进行全面的基因组分析和独立验证,以确认这些观察结果,并进一步阐明这一乳头状肾细胞癌谱系中新兴亚型的临床和生物学意义。
结 论
双相型乳头状肾细胞癌(BPRCC)是乳头状肾细胞癌谱系中的一种独特亚型,其特征为独特的双相组织形态学、节段特异性免疫表型差异和异质性分子图谱。尽管BPRCC与经典“1型”乳头状肾细胞癌共享7号和17号染色体三体等典型细胞遗传学改变,但它持续表现出结构、免疫组化和遗传学差异,尤其是在其鳞状样成分中,包括富集NOTCH、MAPK和DNA损伤修复(DDR)通路改变。这些综合发现强调BPRCC是生物学和临床上独特的形态学及分子实体,支持将其认定为一个独立亚型,这对靶向治疗策略和诊断优化具有潜在意义。
参考文献:
Lu Z, Zhou Y, Fan W, Choksi S, Sultan L, Katz MH, Wang DS, Zhao Q, Yang S. Biphasic (squamoid) papillary renal cell carcinoma: a distinct molecular and morphologic subtype within the PRCC spectrum. Virchows Arch. 2025 Sep 26. doi: 10.1007/s00428-025-04248-6. Epub ahead of print. PMID: 41006900.





