长期以来,抑郁症的治疗主要依赖药物,但治疗周期较长且疗效并不显著。尽管临床上已经发现单次运动能快速改善抑郁情绪,其背后的科学原理却一直模糊不清。
近期,由香港理工大学领导的多中心团队在《Molecular Psychiatry》上发表了Rapid antidepressant effect of single-bout exercise is mediated by adiponectin-induced APPL1 nucleus translocation in anterior cingulate cortex的研究,揭示了这一快速抗抑郁效应背后的关键线路。
团队通过使用C57BL/6J野生型小鼠,并结合Adiponectin基因敲除模型,利用AAV载体递送shRNA在ACC内实现对APPL1或AdipoR1的神经元特异性基因敲低,发现外周脂肪组织分泌的激素脂联素(Adiponectin)是启动大脑快速抗抑郁反应的关键信使,为开发快速有效的抗抑郁干预策略提供了全新靶点。

文章亮点
1. 首次揭示脂肪-大脑轴在快速抗抑郁中的作用:提出并验证了Adiponectin作为外周脂肪因子,通过血脑屏障作用于ACC谷氨酸能神经元,介导运动的快速抗抑郁效应。
2. 发现APPL1核转位的新功能:APPL1不仅是Adiponectin信号转导蛋白,其核内积累还能通过表观遗传机制调控突触可塑性,是快速抗抑郁的新机制。
3. 提出潜在靶点:AdipoR1和APPL1核转位有望作为开发快速起效抗抑郁药物的新靶点。
一、单次运动能引发快速抗抑郁效应
研究人员首先对有/无抑郁症状的人类参与者进行30min的跑步训练,发现其运动后的负面情绪减少。
然后对有/无慢性不可预测应激(CUMS)的小鼠模型进行30分钟跑步机运动,并在运动后不同时间点进行一系列行为学测试,发现小鼠同样出现快速且持续的抗抑郁行为效应。
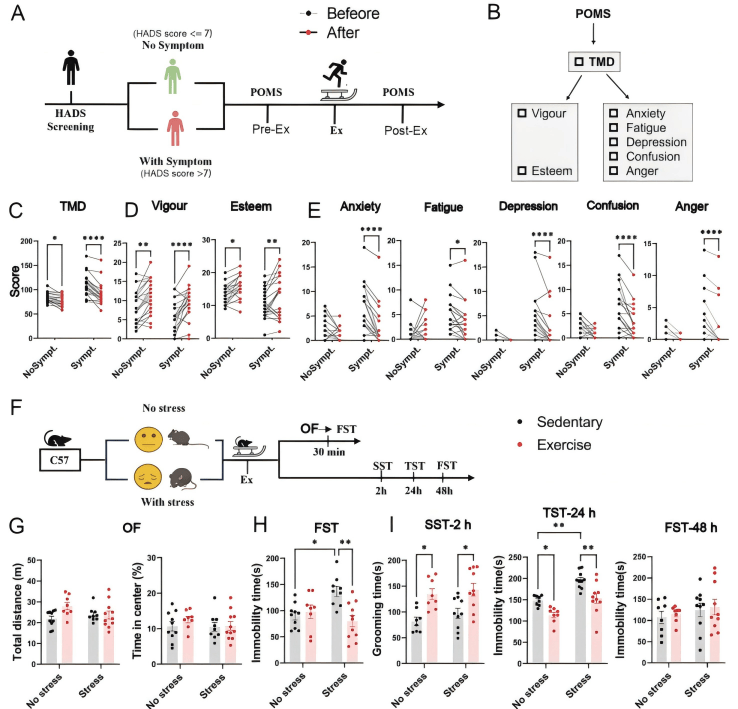
图1. 从临床人群到小鼠模型验证运动的抗抑郁效应
二、定位关键脑区与细胞
为明确单次运动激活的关键脑区与细胞类型,通过脑片c-Fos和神经元类型标志物免疫荧光染色,研究人员锁定ACC谷氨酸能神经元(CaMKII+)为单次运动后激活的关键靶细胞;在体钙成像则实时观测到该群神经元在运动后活动显著增强。

图2.ACC脑区的CaMKII+激活与抗抑郁效应存在因果关系
三、Adiponectin--AdipoR1信号通路是抗抑郁的必要环节
为探究运动效应的外周信号,研究人员通过ELISA检测发现:单次运动能够提高mPFC内的Adiponectin水平,从而改善抑郁行为。进一步研究发现,这一激素是通过作用于ACC谷氨酸能神经元上表达的AdipoR1受体介导效应;该结论在遗传模型中得到验证——在全身性Adiponectin敲除或神经元特异性敲低AdipoR1的小鼠中,运动诱导的神经元激活与抗抑郁行为效应均消失。

图3.确认Adiponectin通过其受体AdipoR1作用于ACC CaMKII
四、APPL1核转位是下游分子机制
研究人员通过功能获得与功能丧失实验证实APPL1在运动诱导的抗抑郁效应中具有关键作用:在ACC神经元中特异性敲低APPL1会阻断该效应,而在全身性APPL1基因敲除小鼠中重新表达APPL1则可挽救。
机制研究发现,运动并未改变APPL1的mRNA水平,提示其调控主要发生在蛋白质层面;免疫荧光定量证实APPL1由细胞质转位至细胞核。
最后,在Adiponectin敲除及AdipoR1敲低小鼠中均观察不到APPL1核转位,说明该步骤依赖于上游Adiponectin–AdipoR1信号通路。

图4.AdipoR1激活后,其下游接头蛋白APPL1进入细胞核
五、APPL1核转位通过表观遗传机制促进突触可塑性
研究阐释了假说的分子通路理论模型图,随后经Western Blot证实,运动通过APPL1核转位诱导了组蛋白H4乙酰化,并促进突触蛋白的持续表达和树突棘的新生。
且研究人员运用药理学技术阻断APPL1的核转位后发现,组蛋白乙酰化、突触蛋白上调、树突棘新生以及抗抑郁行为效应全部被抑制。

图5.T96K改变雌性小鼠小胶质细胞的状态分布
总结与展望
本研究揭示了“运动-脂肪-大脑”轴快速调控抑郁情绪的核心机制,并鉴定出AdipoR1受体及其APPL1核转位有望成为新型快速抗抑郁药物的靶点。
这些发现不仅从科学层面解释了“单次运动快速改善情绪”的内在原理,也为其作为快速缓解抑郁症状的非药物干预策略提供了坚实依据。





