

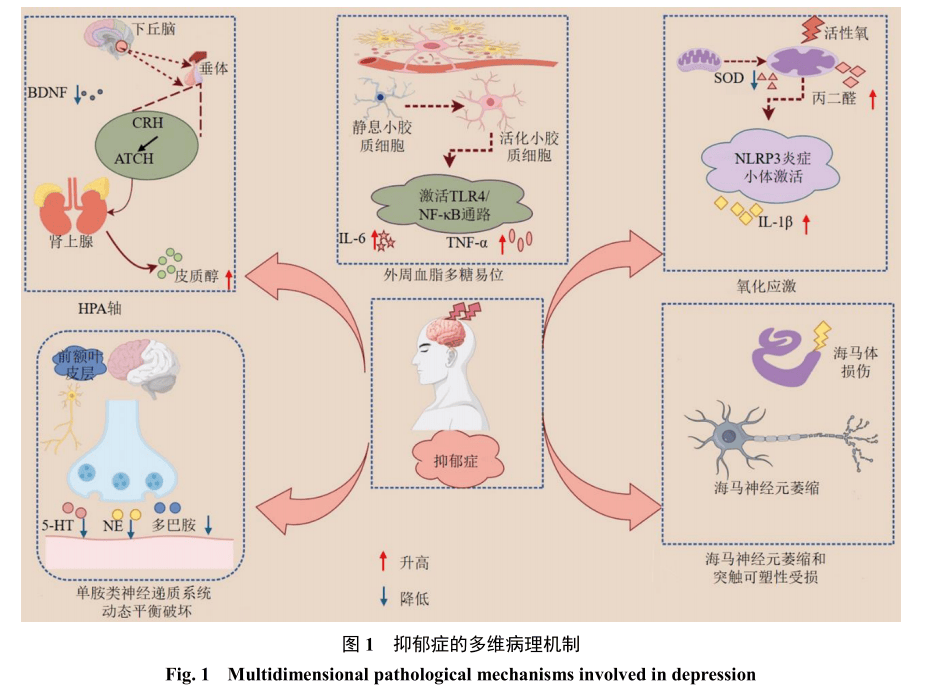
抑郁症是一种复杂的神经精神疾病,具有高致残率、自杀相关死亡风险增加和早逝等特点,已成为全球重大公共卫生问题[1]。其核心临床表现包括持续性快感缺失、认知功能障碍和情绪低落,常伴有食欲紊乱、睡眠结构破坏和精神运动迟滞等躯体症状[2]。除神经精神表现外,抑郁症还可引发肠道屏障损伤、神经免疫失调和神经退行性病变等[3]。尽管现有循证医学证据表明抗抑郁药物联合心理治疗对抑郁症具有临床疗效,但该综合干预模式的效果普遍处于中等水平,且不同个体间存在反应异质性[4-5]。该病的病因学复杂性源于以下病理机制的交汇:(1)单胺类神经递质[多巴胺、5-羟色胺(5-hydroxytryptamine,5-HT)、去甲肾上腺素(noradrenaline,NE)]失衡;(2)下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenal,HPA)轴功能障碍伴皮质醇分泌亢进;(3)小胶质细胞介导的神经炎症;(4)线粒体氧化应激级联反应;(5)海马神经可塑性缺陷(图1)[6-11]。这些相互关联的通路构成了病理生理网络,对传统单靶点药物治疗提出了挑战。此外,合成抗抑郁药物的长期使用可能引发代谢并发症和器官毒性,促使研究转向具有多靶点调节能力和良好安全性的天然化合物。
最新研究阐明了肠道菌群在抑郁症发病机制中的关键作用。人类胃肠道内由细菌、古菌、真菌和病毒组成的复杂微生物群落,统称为第2基因组[12-14]。这一动态生态系统通过微生物-肠-脑轴(microbiota-gut-brain axis,MGBA)与中枢神经系统(central nervous system,CNS)进行双向交流,为抑郁症病因学提供了新的机制解释。临床研究显示抑郁症患者存在肠道菌群失调,其特征为短链脂肪酸(short-chain fatty acid,SCFA)生成减少和Toll样受体4(Toll-like receptor 4,TLR4)/核因子-κB(nuclear factor-κB,NF-κB)介导的神经炎症激活[15-17]。值得注意的是,肠道微生物不仅能合成可直接进行神经信号传导的神经活性代谢物,还能调节脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)表达和神经递质受体谱[18-19]。这些发现使MGBA成为抑郁症治疗的重要靶点。
多糖作为普遍存在的天然大分子,不仅具有抗炎、免疫调节和抗氧化等生物活性,还能通过选择性调节肠道菌群发挥益生元作用[20-21]。微生物对多糖的代谢可产生SCFA,后者通过迷走神经和循环途径增强肠道屏障完整性、调节免疫稳态并发挥神经保护作用[22-23]。现有证据证实多糖可通过菌群依赖性机制改善抑郁行为,包括HPA轴功能正常化、神经炎症抑制和海马神经发生增强等[24-27]。因此本文系统性地聚焦于天然多糖这一类物质,旨在梳理其通过MGBA干预抑郁症的独特多维机制。(1)多糖介导的肠道菌群重塑;(2)多糖的微生物代谢转化;(3)MGBA介导的神经精神效应;(4)多糖的临床应用与现存问题,为开发靶向菌群的抗抑郁策略提供理论框架。
1 数据来源与检索
文献检索以PubMed、Web of Science、CNKI和万方数据知识服务平台。95%以上的文献来自2015年1月—2025年4月,以涵盖过去10年内的最新研究进展。仅纳入中英文原创研究及综述,排除会议摘要、非公开发表数据及非多糖类研究。检索采用主题词与自由词相结合的方式,主要检索词为“抑郁症”“多糖”“微生物-肠-脑轴”“短链脂肪酸”“有关抑郁症多糖临床研究”等。
2 肠道菌群与抑郁症的关联概述
2.1 肠道菌群微环境与抑郁症
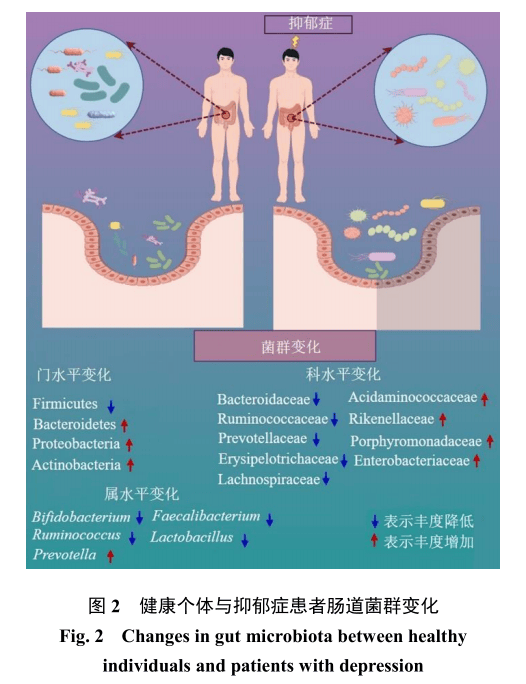
健康成人肠道内有着复杂的微生物群落,包括厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)和放线菌门(Actinobacteria)、和古菌、真菌、病毒及微真核生物。其中厚壁菌门与拟杆菌门占主导地位(约90%),其次为变形菌门和放线菌门,而梭杆菌门与疣微菌门约占10%[28-30]。对维持代谢、免疫及神经功能稳态至关重要的核心有益菌群包括双歧杆菌属、乳杆菌属Lactobacillus、拟杆菌属Bacteroides[31-32]。研究发现抑郁症患者的肠道菌群呈现显著失调。在门水平上,厚壁菌门丰度普遍降低,而拟杆菌门、变形菌门和放线菌门比例升高。在科水平上,酸氨基球菌科、理研菌科、卟啉单胞菌科和肠杆菌科(Enterobacteriaceae)丰度高于健康样本,而拟杆菌科、瘤胃菌科、毛螺菌科(Lachnospiraceae)、普雷沃菌科和丹毒丝菌科(Erysipelotrichaceae)则减少。在属水平上,促炎菌群过度增殖,而抗炎菌群丰度下降[33-35](图2)。多项临床数据表明,抑郁症的菌群特征表现为促炎/条件致病菌过度增殖与有益菌耗竭的共同模式。这种失调通过以下机制最终导致神经炎症和突触可塑性损伤:SCFA合成受阻、色氨酸-犬尿氨酸代谢途径偏移加剧,及TLR4/NF-κB通路激活[36-41]。
2.2 MGBA在抑郁症发病机制中的作用
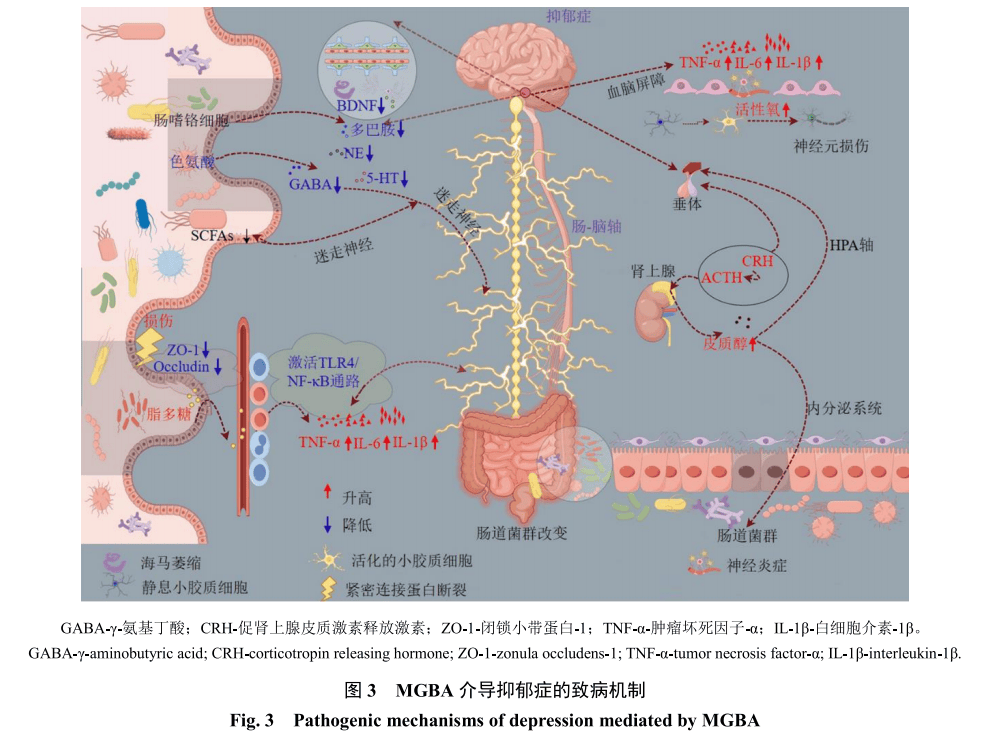
胃肠道凭借其在营养代谢、免疫调节和神经内分泌信号传导中的核心作用被誉为第2大脑[42-43]。其与CNS的双向通讯机制正式命名为肠-脑轴[44-45]。这种多向交互通过神经、免疫及代谢通路实现肠-脑间的双向通讯[46-47]。作为副交感神经信号传递的关键通道,迷走神经不仅介导从情绪调节到免疫稳态等基础生理过程,同时接收肠道菌群代谢产物的调控信号[48-49]。最新证据表明,肠道微生物通过直接神经内分泌刺激和间接自主神经系统调控影响CNS活动,其中微生物代谢产物、内分泌因子和免疫调节分子是主要介质[50-53]。
抑郁症的发病机制与微生物代谢紊乱密切相关,尤其是SCFA生成减少和色氨酸代谢异常[54-55]。SCFA由膳食纤维经厌氧菌发酵产生,占结肠脂肪酸总质量分数的90%以上[56-57]。丁酸通过抑制组蛋白去乙酰化酶发挥神经保护作用,能增强海马BDNF的表达和突触可塑性;丙酸则通过游离脂肪酸受体2介导的机制维持血脑屏障完整性[58-60]。值得注意的是,95%的5-HT合成发生于肠嗜铬细胞,其合成前体色氨酸的生物利用度高度依赖微生物调控。菌群失调导致的色氨酸-5-HT转化障碍会破坏单胺能神经传递,成为抑郁症状发生的关键通路。
3 天然多糖的特性及其对肠道菌群的调控作用
3.1 维持肠道菌群生态平衡
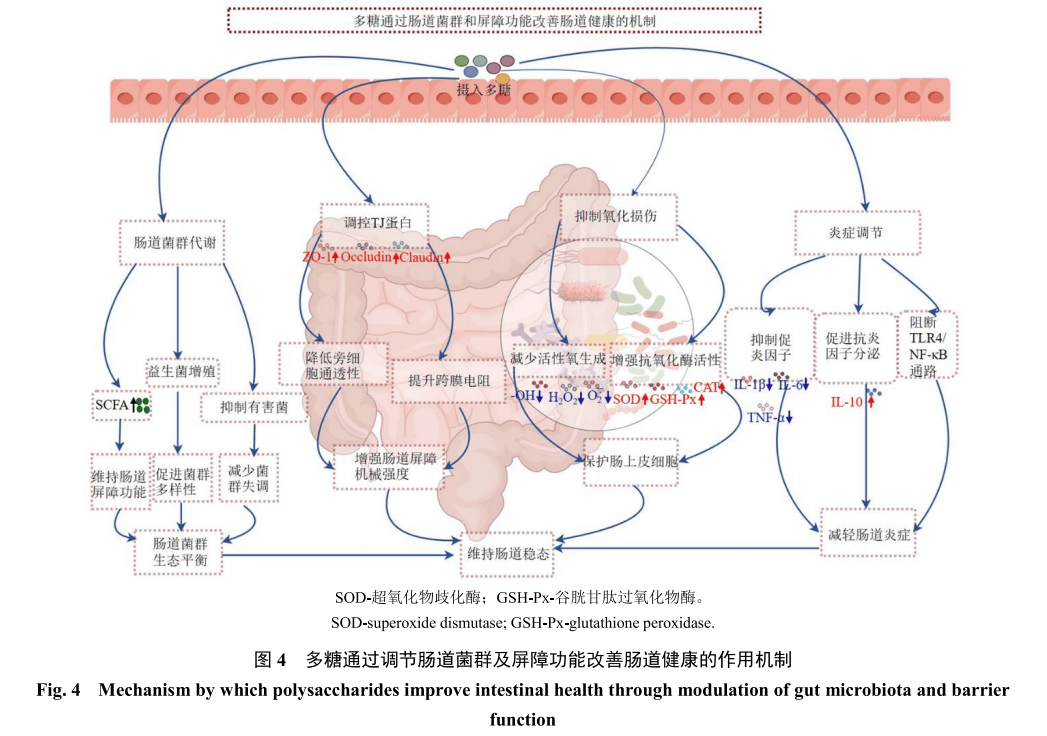
多糖难以被宿主基因组编码的酶类降解,但肠道菌群分泌的降解酶可分解多糖,促进其被宿主消化吸收。不可消化多糖经肠道菌群发酵后生成SCFA不仅能为肠上皮细胞提供能量,促进其增殖并维持肠道屏障功能,还有助于维持肠道稳态并增强免疫耐受[67]。此外在菌群组成方面,多糖可刺激益生菌增殖,同时抑制有害菌生长,从而调节肠道菌群并促进更平衡的菌群结构[68]。研究发现,黄芪多糖能提高酒精性肝损伤小鼠肠道中拟杆菌属的丰度,改善肠道菌群失调[69]。甘草多糖可上调乳杆菌科、疣微菌科和双歧杆菌科、S24-7菌、丹毒丝菌属的丰度,同时下调瘤胃球菌科、毛螺菌科、肠杆菌科和丹毒丝菌科、脱硫弧菌属的丰度[70]。黄精叶多糖可增加小鼠肠道中厚壁菌门的丰度,降低拟杆菌门的丰度;在属水平上,乳杆菌属丰度增加,而毛螺菌科和拟杆菌属丰度降低[71]。铁皮石斛多糖可降低衰老模型小鼠肠道中厚壁菌门/拟杆菌门(F/B)的值,增加乳杆菌属的丰度[72]。葛根多糖可通过促进肠道有益菌增殖并抑制致病菌,有效缓解抗菌药物相关性腹泻引起的结肠病变和肠道菌群失调[73]。芦笋多糖可影响结肠炎小鼠肠道SCFA水平,增加丙氨酸、异戊酸及SCFA总含量[74]。地黄多糖在肠道微生物作用下可发酵生成SCFA,提高肠道中乙酸、丙酸和丁酸水平,对小鼠结肠炎产生有益作用[75]。此外,黄芪多糖能增加SCFA含量,进而调节肠道菌群[76]。竹茹多糖通过上调拟杆菌门和普雷沃氏菌属Prevotella丰度,下调梭菌属和嗜胆菌属丰度来促进SCFA生成,对调节肠道菌群平衡具有生物活性作用[77]。猴头菇多糖可增加SCFA产生菌的丰度,使体内SCFA水平恢复正常,从而减轻环磷酰胺诱导的小鼠免疫抑制[78]。岩藻多糖可提高拟杆菌属、嗜黏蛋白阿克曼菌、布劳特氏菌属Blautia和普雷沃氏菌属的比例,改善小鼠代谢综合征和肠道营养不良[79-81]。因此,天然多糖能优化肠道有益菌群的组成和比例,促进健康菌群生长并降低致病菌丰度,从而使宿主维持健康的微生态平衡系统(图4)。
3.2 对肠道屏障功能的增强作用
肠道作为动物体内与外界环境接触面积最大的器官,不仅是消化吸收的重要场所,更是抵御外源性病原体和毒素的防御屏障[82]。研究表明,多糖可通过调控紧密连接蛋白(tight junction,TJ)表达及空间重组来增强肠道屏障的机械强度。TJ蛋白的动态平衡是维持肠道选择性通透性的结构基础,其功能受肌球蛋白轻链激酶、蛋白激酶C和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)等信号通路调控[83-84]。卵叶车前子、薏苡仁和螺旋藻的多糖可提高人结直肠腺癌Caco-2细胞跨上皮电阻,降低荧光标记葡聚糖的细胞旁转运,同时上调紧密连接蛋白-1(claudin-1)、claudin-3和ZO-1等的表达[85-87]。鸡血藤多糖可提升环磷酰胺诱导的免疫抑制鸡空肠黏膜中ZO-1和claudin-1的基因表达,从而改善肠道屏障功能[88]。多糖对TJ蛋白的调控作用可通过血清标志物体现:黄芪多糖与木糖联用能降低肉鸡血浆中二胺氧化酶和D-乳酸水平,同时上调空肠claudin-1、claudin-3和闭锁蛋白的基因表达,改善生长性能[89]。多糖还能通过抑制氧化应激保护肠上皮细胞免受活性氧介导的损伤。研究发现红藻多糖可降低2,4,6-三硝基苯磺酸诱导大鼠模型结肠组织中的丙二醛含量,抑制诱导型一氧化氮合酶和过氧亚硝酸盐的过度产生,从而缓解肠道屏障损伤[90]。燕麦β-葡聚糖可增强SOD、GSH-Px和谷胱甘肽还原酶的活性,降低脂多糖诱导肠炎模型大鼠脾脏中的氧化应激标志物水平,其作用机制可能与其分子清除外来氢自由基的能力相关[91]。在虾类、肉鸡和断奶仔猪血清中,多糖通过提升SOD、GSH-Px和过氧化氢酶活性,有效恢复氧化-抗氧化系统失衡并维持肠道稳态[92-94]。这些发现表明,多糖可通过酶促与非酶促抗氧化系统的协同调控抵抗活性氧对肠道屏障的损伤。此外黄芪多糖与西洋参多糖联用抑制脂多糖处理断奶仔猪肠道中TLR4/髓样分化因子88(molecule myeloid differentiation factor 88,MyD88)/NF-κB信号通路的异常激活,降低血清IL-1β和TNF-α水平,从而保护肠上皮屏障完整性[95]。酸枣仁多糖通过下调TLR4/NF-κB信号,降低脓毒症模型小鼠肠道中IL-6、IL-1β和TNF-α表达,逆转盲肠结扎穿刺诱导的肠道屏障功能障碍[96]。值得注意的是,多糖的抗炎作用不仅限于抑制促炎因子,还能通过诱导抗炎因子IL-10的分泌实现免疫调控。阿拉伯半乳聚糖可抑制Caco-2细胞中NF-κB活性,刺激IL-10产生,从而降低远端结肠通透性并维持屏障完整性[97]。复合纤维能增加IL-10敲除小鼠肠黏膜中调节性T细胞的分化,减少CD4⁺ T细胞浸润,抑制TNF-α/ TNF受体介导的TJ蛋白通透性升高,最终缓解慢性结肠炎[98]。综上,多糖通过抗氧化、抗炎、调控TJ蛋白及促进SCFA产生等多重途径协同维护肠道功能稳定性(图4)。
4天然多糖通过肠-脑轴调控抑郁症的多维机制
4.1 肠道菌群结构变化与稳态调节
天然多糖作为重要的益生元,能够有效调节肠道菌群的结构紊乱,重建肠道微生态平衡,是其通过MGBA干预抑郁症的关键起始环节。黄秋葵多糖通过降低拟杆菌门与放线菌门的相对丰度,同时提高厚壁菌门和乳杆菌属的比例,从而纠正慢性不可预见温和应激(chronic unpredictable mild stress,CUMS)小鼠的菌群失调[26,99]。杜仲多糖则表现为增加乳杆菌科的丰度,同时抑制变形菌门、Clostridia和Prevotellaceae等与炎症或代谢紊乱相关的类群,通过重塑菌群结构来发挥抗抑郁效应[100-101]。肉苁蓉多糖能够增加拟杆菌门、Parabacteroides和布劳特氏菌属的丰度,这些变化有助于调节免疫平衡和提高SCFA水平[25,102-103]。此外,银杏多糖被证实能有效增强肠道乳杆菌属的丰度[104],芍药多糖[27]、五味子多糖[105]及延胡索多糖[106]也均被报道可通过调节失衡的肠道菌群结构来发挥抗抑郁作用。这些研究共同表明,天然多糖能够通过靶向性地调节特定菌门(厚壁菌门、拟杆菌门、变形菌门)、纲、科(乳杆菌科)和属(乳杆菌属、Russellella、Eubacterium)等的丰度,有效逆转抑郁症相关的菌群生态失调。
4.2 代谢物与表观遗传调控
4.2.1色氨酸代谢的调控色氨酸作为人体必需氨基酸,是5-HT合成的唯一前体,在抑郁症发病机制中具有关键作用[107]。色氨酸主要通过3条代谢通路进行代谢:经肠道吸收后,约95%进入犬尿氨酸代谢通路,剩余少量在色氨酸羟化酶催化下生成5-HT,最终经单胺氧化酶代谢为5-羟吲哚乙酸[108-109]。研究表明急性色氨酸耗竭会降低5-HT合成并诱发抑郁症状,而犬尿氨酸水平升高则通过激活免疫与炎症反应加剧神经损伤[107,110]。多糖可通过调控关键酶活性来调节色氨酸代谢通路,促进5-HT合成并抑制神经毒性代谢物3-羟基犬尿氨酸的产生[111]。研究发现,肉苁蓉总多糖能通过调控肠道菌群互作抑制犬尿氨酸代谢通路,调节HPA轴与下丘脑-垂体-性腺轴功能,同时增强海马区5-HT与BDNF的表达,从而改善抑郁样行为及神经内分泌紊乱[25]。
4.2.2 SCFA的表观遗传调控机制SCFA是由1~6个碳原子组成的饱和脂肪酸,由肠道菌群通过分解植物多糖产生。作为组蛋白去乙酰化酶(histone deacetylase,HDAC)抑制剂,SCFA通过抑制HDAC活性改变染色质构象。其中丁酸盐是最强的天然HDAC抑制剂,可特异性抑制HDAC2/3活性,诱导组蛋白H3和H4的超乙酰化状态,从而激活BDNF和胶质细胞源性神经营养因子等神经保护基因的转录。在抑郁症病理机制中,SCFA通过以下途径发挥保护作用:(1)调控神经免疫微环境,SCFA通过抑制NF-κB信号通路减少IL-6和TNF-α释放,同时促进抗炎因子IL-10和转化生长因子-β表达,从而缓解海马区小胶质细胞的过度激活[112]。(2)维持血脑屏障完整性,SCFA通过上调ZO-1和闭锁蛋白表达降低肠道通透性,阻断脂多糖等促炎成分进入CNS[113]。(3)调节神经递质系统,SCFA通过激活肠嗜铬细胞促进5-HT前体色氨酸合成,同时抑制吲哚胺2,3-双加氧酶活性并减少犬尿氨酸通路激活,从而提高脑内5-HT和多巴胺水平[114]。临床研究证实,抑郁症患者粪便中SCFA浓度降低,且与汉密尔顿抑郁量表评分呈负相关[115]。值得注意的是,不同SCFA作用存在差异。丁酸盐对表观遗传调控作用最为显著,而丙酸和乙酸则更多通过代谢通路间接发挥作用。此外,SCFA的神经保护效应依赖于肠道菌群多样性[116]。Xiong等[117]发现逍遥散多糖可增加产丁酸盐菌多样性,从而使肠道丁酸盐含量增加,改善CUMS诱导的抑郁样行为。Yan等[26]发现黄秋葵多糖恢复CUMS小鼠丁酸、乙酸、丙酸等SCFA浓度。这些发现为基于SCFA的抗抑郁策略提供了理论依据,提示恢复SCFA稳态可能成为未来抑郁症治疗的重要方向。
4.3 炎症免疫与神经可塑性调控
4.3.1 TLR4/NF-κB通路与神经炎症神经炎症是指CNS实质中神经元、小胶质细胞和星形胶质细胞对病原性刺激产生的级联炎症反应[118]。抗原刺激或神经损伤可诱导损伤相关分子模式的产生,激活神经胶质细胞并破坏血脑屏障完整性。这种失调会促进外周免疫细胞浸润和促炎因子风暴,通过自我强化的炎症循环加剧神经损伤[119-120]。NF-κB通路是免疫功能、炎症反应、应激应答和细胞存活的关键调控枢纽。TLR4通过MyD88募集炎症细胞,触发NF-κB、TNF-α和IL-1β等促炎介质释放。研究表明,应激可升高海马区TLR4和NF-κB表达,而TLR4基因敲除能缓解这些应激效应[121]。临床研究发现,经历躯体或社会应激的抑郁症患者存在NF-κB通路激活现象。CUMS啮齿类动物实验证实NF-κB信号通路会促进抑郁样行为并抑制神经干细胞增殖[122]。黄芪多糖可通过调节肠-脑轴并抑制脂多糖诱导的MAPK/NF-κB通路来减轻神经炎症。降低p-c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)、p-细胞外调节蛋白激酶(extracellular regulated protein kinase,ERK)和p-p65磷酸化水平,同时减少IL-1β和TNF-α表达[123]。五味子多糖可上调小胶质细胞低密度脂蛋白受体相关蛋白1表达,抑制NF-κB核转位,降低TNF-α、IL-6和IL-1β释放,同时增强M2型标志物IL-10和精氨酸酶1表达[124]。灵芝多糖通过抑制NOD样受体热蛋白结构域3(NOD like receptor family pyrin domain containing 3,NLRP3)炎症小体活化,并阻断NF-κB信号通路,从而降低半胱氨酸天冬氨酸蛋白酶-1、IL-1β和IL-18表达[125]。石菖蒲酸性杂多糖可抑制小鼠小胶质BV2细胞中TLR4介导的MyD88/NF-κB和磷脂酰肌醇3激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)通路,减少脂多糖诱导的TNF-α、IL-6、诱导型一氧化氮合酶和环氧合酶-2释放,同时阻止活性氧过度产生和线粒体损伤[126]。杜仲多糖抑制小胶质细胞介导的TLR4/ NF-κB/MAPK信号通路激活和脂多糖释放,并调控神经发生模式,从而发挥抗抑郁作用[100-101]。这些研究结果表明,TLR4/NF-κB通路是神经炎症的关键枢纽,而结构多样的天然多糖为抑郁症治疗提供了多靶点干预策略。
4.3.2 MAPK/PI3K/Akt信号通路对神经可塑性的调控作用天然多糖通过调节肠道菌群及其代谢产物,可间接激活CNS的MAPK/PI3K/Akt信号轴,进而调控神经可塑性。在抑郁症中,多种分子改变共同作用于Akt和MAPK信号通路。Akt通过MAPK和哺乳动物雷帕霉素靶蛋白网络关键调控葡萄糖代谢、细胞凋亡、增殖及迁移等细胞过程[127]。抑郁症的特征性神经功能障碍表现为神经可塑性受损,Akt已成为精神疾病的关键调控因子,其功能缺陷与抑郁行为密切相关[128-129]。该激酶还能整合多巴胺和5-HT神经传递,参与重性抑郁障碍的发病机制[130-131]。MAPK级联反应将细胞外刺激转化为多样化应答,通过核转位机制调控应激反应、炎症及细胞存活,同时影响突触可塑性和高级认知功能[132-133]。研究表明MAPK参与抑郁症的发病机制和治疗响应[134]。该通路通过ERK磷酸化Ets样蛋白-1和环磷腺苷效应元件结合蛋白(cAMP-response element binding protein,CREB)等转录因子,实现环境因素信号向基因组应答的传递。人类研究与动物模型均显示,抑郁症相关脑区存在ERK通路下调现象,而抗抑郁药则通过ERK活性正常化发挥治疗作用[134]。在抑郁症发病过程中,作为PI3K下游效应分子,Akt通过磷酸化糖原合酶激酶-3β(glycogen synthase kinase-3β,GSK-3β)抑制异常微管相关蛋白tau(microtubule-associated protein tau,tau)磷酸化,维持突触完整性并促进树突棘形成;其功能异常导致海马BDNF表达降低及突触可塑性受损。研究发现枸杞多糖通过激活胰岛素受体底物1/PI3K/Akt信号通路,抑制GSK-3β活性,降低tau蛋白磷酸化水平,上调突触相关蛋白表达以增强神经可塑性[135]。黄秋葵多糖通过激活PI3K/Akt通路,改善tau蛋白病理并恢复突触功能[136]。五味子多糖则通过降低p38/ERK/JNK磷酸化水平修复海马神经元形态[137]。
4.4 神经-内分泌与递质系统重塑
4.4.1HPA轴调控HPA轴作为神经内分泌系统调节应激反应的核心环节,其过度激活是抑郁症发病的关键机制。在长期应激状态下,CRH和ACTH的负反馈调节失效,导致皮质酮持续升高[138],进而引发HPA轴功能紊乱,这一过程可造成海马神经元损伤,从而诱发或加重抑郁。因此,通过降低皮质酮、CRH和ACTH水平、恢复HPA轴负反馈机制,成为抗抑郁治疗的重要策略。研究发现黄精多糖可抑制脂多糖和CUMS模型中的皮质酮水平[139];枸杞多糖通过下调NMDA受体2B亚型和钙/钙调素依赖性蛋白激酶II(calcium-calmodulin (CaM)-dependent protein kinase II,CaMKII)蛋白表达、降低血清皮质酮,增强HPA轴负反馈,改善创伤后应激障碍大鼠的抑郁行为[140];百合多糖与黄芪多糖联用可减轻海马CA1区神经细胞病理损伤,降低皮质酮和ACTH浓度,且复合效果优于单一成分[141];铁皮石斛多糖则有效降低抑郁模型小鼠血清中CRH、ACTH和皮质酮水平,逆转HPA轴功能异常[142]。这些结果表明,多糖类物质可通过抑制HPA轴过度活化、促进负反馈调节,从而发挥抗抑郁作用。
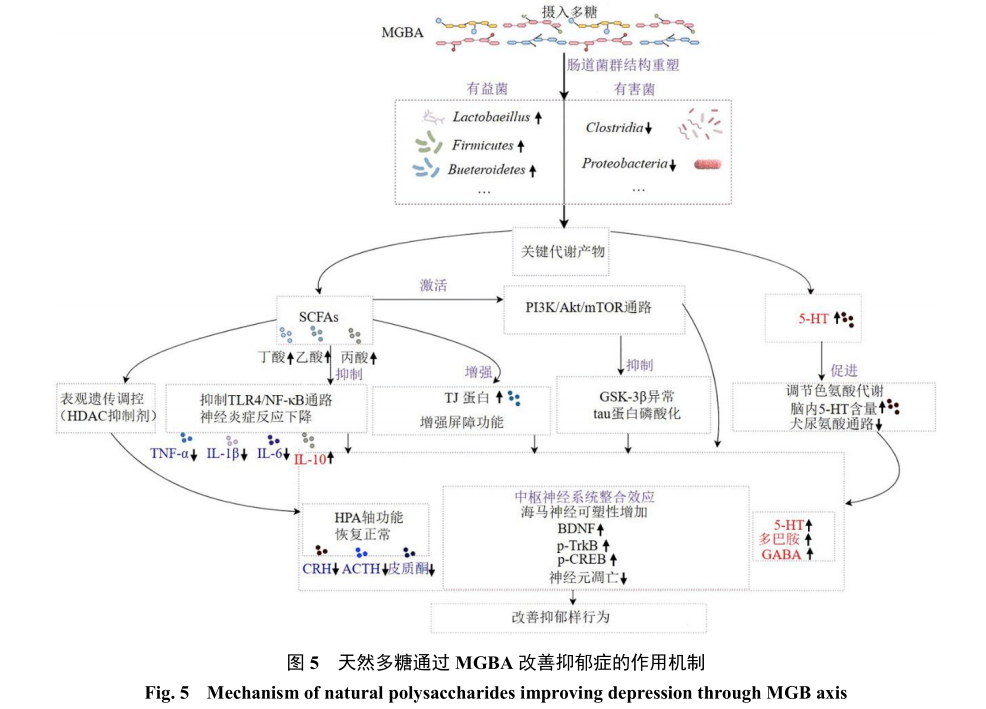
4.4.2 BDNF/酪氨酸激酶受体B(tyrosine kinase receptor B,TrkB)/CREB通路BDNF在CNS内广泛表达,通过与其特异性受体TrkB结合,进而磷酸化Akt并激活转录因子CREB,从而发挥神经保护作用[143]。通过突触前和突触后TrkB受体的激活,BDNF调控神经元存活与突触可塑性[144]。根据抑郁症的神经营养假说,慢性应激会降低海马区BDNF表达,该现象与抑郁行为相关。BDNF-TrkB复合体通过N-甲基-D-天冬氨酸受体(N-methyl-D-aspartic acid receptor,NMDAR)/CaMKII通路诱导突触重塑,磷酸化TrkB能增强NMDAR功能以促进谷氨酸能传递,同时防止兴奋性毒性[145-146]。五味子多糖可调节TrkB受体磷酸化增强BDNF表达与CREB磷酸化,抑制海马神经元凋亡并恢复5-HT系统功能[147]。紫菜多糖通过激活海马区BDNF/ TrkB/ERK/CREB通路上调BDNF表达并促进TrkB、ERK和CREB磷酸化[148]。该级联反应可减少神经元凋亡,同时刺激神经发生和树突棘密度增加,拮抗慢性应激诱导的抑郁行为。何首乌多糖能将小胶质细胞极化表型从脂多糖诱导的M1型转为M2型,并通过激活BDNF/TrkB/CREB通路支持神经元存活与突触可塑性[149]。藤椒多糖可通过激活CREB/BDNF信号通路增强突触功能,最终表现出抗抑郁效应[150]。天然多糖通过MGBA改善抑郁症作用机制见图5。
5 临床研究现状
近期临床前研究表明,多糖类化合物可通过调节肠道菌群组成、增强肠道屏障完整性及调控脑内神经递质平衡等途径缓解抑郁样行为。然而,此类研究目前仍局限于模型动物及体外机制探索,多糖作为抗抑郁药物的临床转化尚处于早期阶段。一项为期6周的随机双盲安慰剂对照试验显示,枸杞多糖300 mg/d对青少年亚阈值抑郁症具有显著疗效。干预组汉密尔顿抑郁量表24项版评分降低幅度显著高于对照组,尤其在认知功能障碍、精神运动迟滞和绝望症状方面改善明显,其缓解率达33.3%,而对照组仅为7.14%[151]。机制研究显示枸杞多糖可能通过抗炎途径发挥作用,表现为选择性降低IL-17A水平及调节细胞因子网络连接性[152]。然而在合并抑郁症的冠心病患者中,仅菊粉-益生菌的联合治疗能降低贝克抑郁量表评分和TNF-α水平,同时提升菌群多样性和IL-10水平[153]。尽管这些结果具有积极意义,仍需开展多中心大样本试验以确定最佳给药方案、长期疗效及精确作用机制。
6 结语与展望





