

抑郁症是全球范围内最为常见、由多因素导致的精神障碍类疾病,以情绪低落、不安、失眠为主要临床特点,严重者可出现自杀倾向[1]。抑郁症的高患病率和低治愈率,不仅严重影响了患者的日常生活质量和身心健康,也给家庭和社会带来了严重负担[2]。中药治疗抑郁症的效果优、历史久,临床和实验研究均显示中药治疗抑郁症具有良好的效果[3]。栀子为茜草科植物栀子Gardenia jasminoides Ellis的干燥成熟果实[4],文献报道显示栀子在抑郁症治疗方剂中的应用频率高达14.87%[5]。其中环烯醚萜苷类成分栀子苷及其苷元京尼平等是主要抗抑郁成分[6]。京尼平龙胆双糖苷(genipin-1-β-D-gentiobioside,GG)是栀子的主要有效成分[7],其化学结构与栀子苷相似,只是多了1个糖苷基团。一般来说,结构相似的化合物具有相似的生物效应,因此,GG可能具有与栀子苷相同的抗抑郁活性。课题组前期研究证实了GG的抗抑郁药效[8],为其能够发挥抗抑郁作用提供了实验依据。
鉴于此,本研究首先基于DARTS联合无标记LC-MS蛋白质组学对GG脑内潜在作用靶点进行筛选,再将筛选获得的潜在靶点与抑郁症疾病靶点数据库进行交集,从而获得GG脑内抗抑郁潜在作用靶点。接着,对GG与潜在靶点之间的作用进行验证,最后基于靶点初步探讨GG发挥抗抑郁作用的机制。
1材料
1.1 动物
1.2药品与试剂
1.3 仪器
PowerPacTM Basic电泳仪及制胶设备(美国Bio-Rad公司);IKA T10 ULTRA-TURRAX型高速分散匀质机(德国IKA公司);AKTA pure M1型蛋白中压层析系统(美国GE公司);Universal Hood II型凝胶成像系统(上海天能科技有限公司);Octet Red 96型Octet分子相互作用仪(美国ForteBio公司);LightCycler 480 II型实时荧光定量PCR仪(瑞士Roche公司)。
2 方法
2.1 DARTS技术
DARTS技术的实验方法主要参见文献报道[15]。具体步骤为:用PBS溶液灌注3只小鼠,取出脑组织,PBS溶液清洗后,用剪刀剪碎脑组织,放入预冷的离心管中,加入适量含蛋白酶抑制剂的RIPA裂解液,用匀浆仪对脑组织进行匀浆。匀浆后在冰上充分裂解30 min,转移至预冷的1.5 mL离心管中,4 ℃、12 000 r/min离心20 min,将上清转移至预冷的1.5 mL离心管中,加入TNC(100 mmol/L CaCl2、500 mmol/L Tris-HCl、500 mmol/L NaCl,pH 8.0)。采用BCA试剂盒检测蛋白浓度,将上清液稀释成2μg/μL,给药组加入GG(20 μmol/L),对照组加入与等体积的DMSO,室温孵育20 min。将经GG或DMSO处理的上清溶液40 μL分别加入到PCR管中,每组3管,并添加4 μL链霉蛋白酶溶液(链霉菌素∶蛋白质=1∶800),25 ℃消化25 min。待消化结束后,分别在每个PCR管加入相应体积的蛋白酶抑制剂混合物终止消化反应,并在冰上孵育10 min使终止反应更加充分,终止后的反应液进行送样处理。
2.2无标记LC-MS和数据分析
使用无标记LC-MS[12]进行蛋白质组学定量分析,由上海中科新生命生物科技有限公司检测。
2.3 网络药理学分析
通过疾病靶点数据库DisGeNET(http://www. disgenet.org/)和GeneCards(https://www.genecards. org/)提取抑郁症靶点的相关基因(每个数据库取前300个),合并后去重,共获得400个基因。再通过Venn分析,将无标记LC-MS蛋白质组学获得的给药组特有的差异表达蛋白的基因与抑郁症疾病靶点基因取交集,从而获得GG脑内抗抑郁潜在靶点。
2.4 PICK1融合蛋白的表达与纯化
通过NCBI检索小鼠PICK1基因完整的CDS序列,通过检索获得的CDS序列设计上下游引物,PICK1上游引物5’-TAAGAAGGAGATATACCATG- GGCCACCACCATCACCACCACATGTTTGCAGA-CTTA-3’,下游引物5’-TTGTCGACGGAGCTCGA- ATTCTCAGGAGTCACACCA-3’。利用引物以及小鼠脑组织的cDNA对PICK1基因进行PCR扩增,获得N端带有His-tag的PICK1基因序列。利用同源重组酶通过同源重组的方式将PICK1基因连接到pET-28a(+),进而成功构建重组原核表达载体。
将构建好的重组表达载体pET28a-PICK1转化至大肠杆菌BL21(DE3),并涂在含有卡那霉素的固体LB培养基,第2天挑取单菌落接种于含卡那霉素的LB液体培养基中培养,待600 nm处的吸光度(A)值达到0.7左右时,加入1 mol/L的IPTG使终浓度为0.5 mmol/L,放入摇床,22 ℃、200 r/min过夜诱导表达。收集过夜诱导表达的菌体,用含有Cocktail的裂解缓冲液(500 mmol/L NaCl、50 mmol/L HEPES、5 mmol/L异吡唑、5%甘油,pH 7.5)对菌体进行重悬。使用高压细胞破碎仪破碎(4 ℃、1 100 Pa,5 min),破碎后对细胞裂解液进行高速离心(4 ℃、20 000 r/min,30 min),用0.45 µm滤膜对离心后获得的上清进行滤过。将上清上样到HisTrap HP亲和色谱柱中,通过AKTA纯化PICK1融合蛋白。收集100%的Buffer B(500 mmol/L NaCl、50 mmol/L HEPES、250 mmol/L异吡唑,pH 7.5)洗脱的样品,进行SDS-PAGE凝胶电泳,检测PICK1蛋白表达。
2.5 生物层干涉技术(biolayer interferometry,BLI)检测GG与PICK1的亲和力
采用双扣除的方式对GG与PICK1之间的亲和力进行检测,即药物溶剂以及空白传感器的双重扣除,从而尽可能地排除GG与PICK1之间的非特异性结合。实验步骤如下:对传感器进行预湿,然后将PICK1蛋白固化到传感器上,经过PBS和PBST的平衡后,浸入已知浓度的GG中进行结合,结合后再次浸入PBST中,从而使结合到PICK1蛋白上的小分子解离下来,这样就会形成不同浓度的分析物的结合和解离过程。对空白传感器进行同样的步骤处理,最后用于双扣除。其中平衡、结合与解离步骤连续检测4次,多个浓度进行拟合,从而计算动力学参数。
2.6分子对接实验
从AlphaFoldDB数据库中下载小鼠源PICK1蛋白3D结构(AF-Q62083-F1)PDB文件,使用Schrodinger软件的Protein Preparation Wizard模块优化蛋白结构,包括加氢、修复缺失残基、优化氢键网格和能量最小化。通过PubChem数据库下载GG的2D SDF格式文件,用LigGprep模块对小分子进行能量最小化生成3D构象。使用Schrodinger软件的Ligand Docking模块进行分子对接。
2.7 PICK1突变体蛋白的表达与纯化
以“2.4”项下重组表达载体pET28a-PICK1为模板,利用突变引物进行突变重组表达载体的构建。将构建成功的突变重组表达载体转化大肠杆菌BL21(DE3)进行原核表达和纯化,具体步骤同“2.4”项。
2.8 慢性不可预见性轻度应激(chronic unpredictable mild stress,CUMS)抑郁模型小鼠的构建与给药
60只雄性C57BL/6小鼠随机分成对照组、模型组及GG低、中、高剂量(25、50、100 mg/kg)[8]组和氟西汀(10 mg/kg)组,每组10只。除对照组外,其余小鼠每天给予12种刺激方式(鼠笼侵袭、禁水、禁食、噪声、潮湿垫料、冰水游泳、明暗颠倒、夹尾、热刺激、灯光频闪、束缚、摇笼)中的任意2种进行刺激。每天的2种刺激方式为随机选取,同一刺激方式不同时出现,并且连续2 d的刺激方式不重复,以确保不可预测性,给予小鼠8周的持续刺激建立CUMS抑郁模型。造模第6周开始,各给药组ig相应药物,对照组和模型组ig等体积的生理盐水,1次/d,连续给药3周[8]。给药结束后,收集各组小鼠海马组织,进行qRT-PCR和Western blotting检测。
2.9 qRT-PCR检测GG对CUMS小鼠海马组织PICK1以及突触可塑性相关基因表达的影响
取各组小鼠海马组织,使用RNA提取试剂盒提取总RNA。根据Hifair®Ⅲ 1st Strand cDNA Synthesis SuperMix for qPCR(gDNA digester plus)逆转录试剂盒合成cDNA。使用Hieff®qPCR SYBR Green Master Mix(No Rox)试剂盒的预混试剂和样品,采用罗氏LightCycler 480 Ⅱ实时荧光定量PCR仪进行分析。以GAPDH作为内参基因,采用2−ΔΔCt计算各基因的相对表达量。引物由擎科生物科技有限公司合成,引物序列见表1。

2.10 Western blotting检测GG对CUMS小鼠海马组织PICK1以及突触可塑性相关蛋白表达的影响
取各组小鼠海马组织,加入含有磷酸酶抑制剂和蛋白酶抑制剂的RIPA组织裂解液进行匀浆,4 ℃、12 000 r/min离心15 min,取上清,使用BCA试剂盒进行蛋白定量。蛋白样品经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,加入5%牛血清白蛋白,室温封闭1 h,加入一抗,4 ℃孵育过夜。次日,TBST洗膜3次,每次10 min,加入二抗,室温孵育1 h,洗膜后,使用增强型化学发光显色液显影,采用Image J软件分析条带的灰度值。
2.11 统计学分析
采用GraphPad Prism 8.0软件对实验结果进行统计学分析。结果以表示,采用单因素方差分析(One-way ANOVA)进行统计学处理。
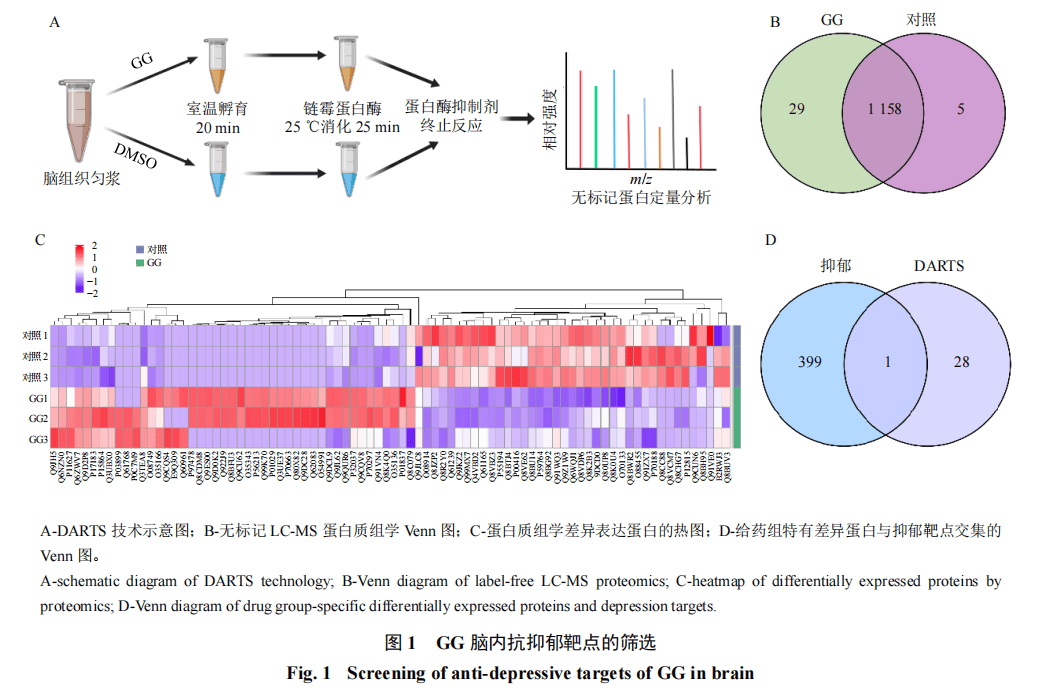
3 结果
3.1 GG脑内抗抑郁潜在靶点的筛选
基于DARTS联合无标记LC-MS蛋白质组学(图1-A),筛选出GG在小鼠脑组织内的潜在蛋白质靶点,根据有/无的标准,通过与对照组进行Venn分析,GG组共特有29个潜在蛋白质靶点(图1-B)。对蛋白质组学差异表达蛋白进行热图分析,结果见图1-C。搜索DisGeNET数据库和GeneCards数据库的前300个抑郁症靶点,去重后共得到400个疾病靶点,将其与29个潜在蛋白靶点交集,共获得1个潜在抗抑郁蛋白质靶点PICK1(图1-D)。
3.2 GG与PICK1间相互作用分析
使用BLI检测GG与PICK1之间的亲和力,结果如图2-A和表2所示,GG与PICK1之间存在较强的相互作用,两者之间的亲和力(KD)值为1.915×10−5mol/L。采用分子对接对两者之间的结合模式和结合位点进行分析,结果如图2-B~D所示,GG与PICK1之间存在相互作用,且主要由GLN91、LYS83、ILE37、SER36、ILE35与GG间形成的氢键发挥作用。

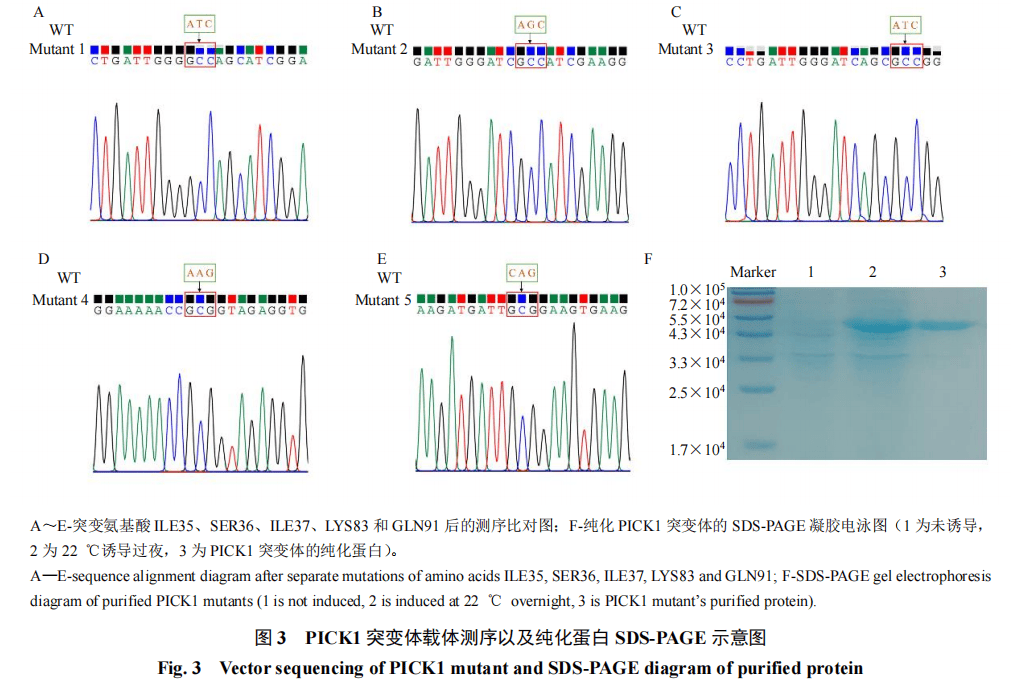
3.3氨基酸定点突变
基于分子对接结果,GG与PICK1之间的结合位点主要为ILE35、SER36、ILE37、LYS83和GLN91。对这5个关键氨基酸分别进行氨基酸定点突变,如图3-A~E所示,突变后通过测序比对确定突变载体构建成功。将构建的突变表达载体分别转化大肠杆菌BL21(DE3),通过原核表达纯化获得突变体蛋白,结果如图3-F所示,成功表达并纯化获得所需蛋白。

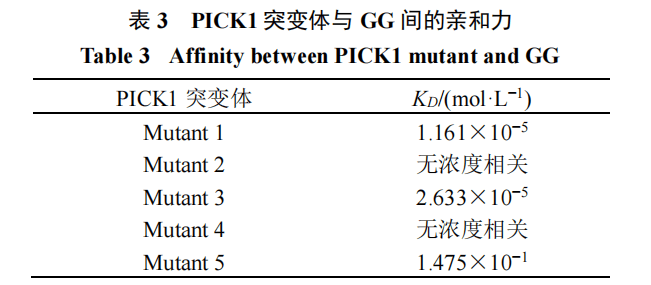
3.4 GG与PICK1突变体之间的亲和力分析
获得5个关键氨基酸的突变体后(图4-A),通过BLI分别检测GG与PICK1突变体之间的亲和力。结果见图4-B~F和表3,ILE35、SER36、ILE37、LYS83和GLN91 5个关键氨基酸分别突变成丙氨酸,并分别命名为Mutant 1、Mutant 2、Mutant 3、Mutant 4、Mutant 5。采用BLI检测突变体与GG之间的亲和力,Mutant 2和Mutant 4与GG之间的KD值虽然相对于野生型升高但失去剂量相关性,说明突变后改变了其与GG之间的相互作用,Mutant 5与GG之间的KD值显著降低,Mutant 1和Mutant 3与GG之间的KD值虽无太大变化,但结合解离曲线也不如野生型的明显。以上结果表明SER36、LYS83和GLN91这3个氨基酸在GG与PICK1之间的相互作用中起关键作用,ILE35和ILE37发挥部分作用但并未起关键作用。

3.5 GG对抑郁模型小鼠海马组织中PICK1、GluA2、PSD95 mRNA和蛋白表达的影响
PICK1在突触可塑性中发挥关键作用,其能够与α-氨基羟甲基异唑丙酸(α-amino-3-hydroxy-5-methylisoxazole-4-propionic acid,AMPA)受体亚基GluA2结合,调控AMPA受体的内吞和膜表达,从而影响突触可塑性[16]。本研究采用qRT-PCR和Western blotting检测GG对CUMS小鼠海马组织中PICK1、GluA2、PSD95的mRNA和蛋白表达的影响,结果如图5、6所示,与对照组比较,模型组小鼠海马组织中PICK1的mRNA和蛋白表达水平显著升高(P<0.01),GluA2、PSD95的mRNA和蛋白表达水平显著降低(P<0.05、0.01);与模型组比较,各给药组小鼠海马组织中PICK1的mRNA和蛋白表达水平显著降低(P<0.05、0.01),GG中、高剂量组和氟西汀组小鼠海马组织中GluA2、PSD95的mRNA和蛋白表达水平显著升高(P<0.05、0.01)。表明GG可能通过结合PICK1,改变PICK1、GluA2、PSD95的mRNA和蛋白表达水平,从而改变突触可塑性,进而发挥抗抑郁作用。





