摘要:肺癌是全球发病率和死亡率最高的恶性肿瘤,被称为 “癌王”。尽管靶向治疗(如 EGFR-TKIs)、免疫检查点抑制剂(ICIs)和化疗显著改善了部分患者预后,但耐药、小细胞肺癌(SCLC)预后极差等问题仍未解决,5 年生存率仅 10%-20%。在此背景下,双特异性抗体(bsAbs)作为 “下一代抗体” 应运而生 —— 它能同时结合两个不同抗原或同一抗原的两个表位,通过“双靶协同”实现多种创新作用机制。目前已有 3 款双抗获批肺癌适应症,数十款进入临床阶段,为耐药、难治性肺癌患者带来新希望。本文将从肺癌治疗困境出发,拆解双抗的结构特点、核心作用机制、临床 “战绩”,并分析当前挑战与未来方向,让读者全面理解这一新型疗法的价值。

一、肺癌治疗的困境:现有方案为何仍需突破?
要理解双特异性抗体的重要性,咱们先从肺癌治疗的现状说起。
肺癌主要分为两大类型:非小细胞肺癌(NSCLC)和小细胞肺癌(SCLC)。其中,NSCLC 占比约 85%,SCLC 占 10%-15%,但两者的治疗困境却同样突出。
从数据来看,全球每年新增肺癌病例约 220 万,死亡 179 万,中国患者占比不小 。更严峻的是,多数患者确诊时已处于晚期,NSCLC 的 5 年生存率仅 10%-20%,SCLC 更差 —— 早期患者中位生存期仅 2 年,晚期患者仅 1 年。
现有治疗方案虽有进步,但短板明显:
靶向治疗:耐药是绕不开的坎
对于携带表皮生长因子受体(EGFR)、间变性淋巴瘤激酶(ALK)等突变的 NSCLC 患者,酪氨酸激酶抑制剂(TKIs)(如奥希替尼)能显著延长生存期。但约 1-2 年后,患者几乎都会出现耐药 —— 比如 EGFR-TKI 耐药中,5%-10% 是因间质 - 上皮转化因子(cMET)扩增,导致肿瘤绕开 EGFR 信号继续生长。
免疫治疗:获益人群有限
免疫检查点抑制剂(ICIs)(如 PD-1/PD-L1 抗体)通过解除肿瘤对免疫细胞的抑制,让 T 细胞 “重新激活” 杀肿瘤。但仅 10%-25% 的肺癌患者能从单药 ICIs 中获益,且部分患者会出现 “免疫耐药”。
SCLC:治疗手段严重不足
SCLC 恶性程度高、进展快,对化疗初始敏感但极易复发,目前缺乏有效的靶向或免疫方案,患者几乎无长期生存可能。
正是这些未被满足的需求,让科学家将目光投向了 “下一代抗体”—— 双特异性抗体。
二、双特异性抗体:肺癌治疗的 “下一代抗体” 新势力2.1 什么是双特异性抗体?
咱们先明确一个概念:单克隆抗体(单抗)是目前临床常用的抗体药物(如西妥昔单抗、帕博利珠单抗),但它只能结合一个抗原或表位,就像 “单靶点导弹”。
而双特异性抗体(bsAbs),顾名思义,能同时结合两个不同的抗原(或同一抗原的两个表位),相当于 “双靶点导弹”。这种特性让它能突破单抗的局限,实现更复杂的治疗效果 —— 比如同时阻断两个致癌信号,或把免疫细胞 “导航” 到肿瘤身边。
2.2 双抗的发展难点:从 “概念” 到 “临床” 为何用了半个世纪?
双抗的想法早在几十年前就有,但直到近年才进入临床,核心难点在于生产效率低。传统方法生产双抗时,只有 12.5% 的产物是目标双抗,其余多是无功能的 “杂质”(如单链错配、聚合体),不仅产量低,还难纯化。
为解决这个问题,科学家基于天然抗体(如 IgG、重链抗体)开发了多种优化策略,最终让双抗的 “有效产出” 大幅提升。
2.3 双抗的三大结构类型:不同设计有何优劣?
根据结构是否保留 IgG 的核心片段,双抗主要分为三类(见图 1),不同类型的特点直接影响其疗效和临床应用:
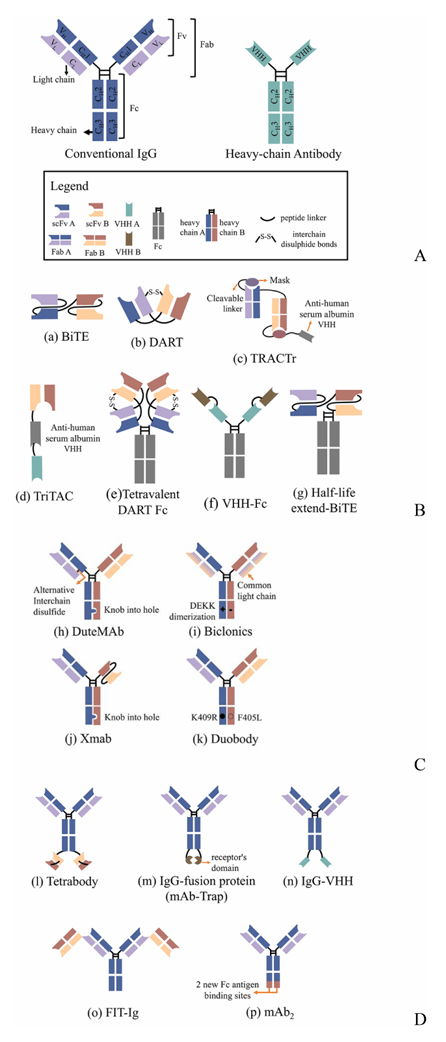
无 IgG 样双抗:“小而灵活” 但半衰期短
这类双抗由抗体片段(如单链可变片段 scFv、重链可变区 VHH)组成,比如大家常听说的BiTE(双特异性 T 细胞衔接器)、DART(双亲和重定向抗体)。
优势:分子量小,能更好地穿透肿瘤组织,到达深层病灶;生产相对简单。
劣势:没有可结晶片段(Fc 段)——Fc 段不仅能延长抗体在血液中的停留时间(半衰期),还能介导抗体依赖性细胞毒性(ADCC)、抗体依赖性细胞吞噬(ADCP)等 “额外杀瘤作用”。因此,这类双抗半衰期短,需要频繁给药,且缺乏 Fc 介导的免疫效应。
优化方案:通过融合 Fc 段(如 VHH-Fc)或结合抗人血清白蛋白(HSA)的片段(如 TRACTr、TriTAC),延长其半衰期。
不对称 IgG 样双抗:“接近天然” 但纯化难
这类双抗保留了 IgG 的基本结构(两条重链、两条轻链),但通过分子改造(如 “knob-into-hole”“DEKK 突变”)让轻重链正确配对,比如Xmab、Duobody。
优势:结构接近天然 IgG,有 Fc 段,半衰期长,能介导 ADCC/ADCP;临床应用时给药频率低,患者依从性好。
劣势:即使经过改造,传统生产仍难完全避免错配,纯化成本高;分子设计时需考虑的因素更多(如链配对、稳定性)。
对称 IgG 样双抗:“稳定易产” 但需关注理化性质
这类双抗通过在常规 IgG 上融合额外的抗原结合片段(如 IgG-VHH、FIT-Ig),或改造 Fc 段形成新结合位点(如 mAb2),无需担心轻重链错配。
优势:生产相对简单,稳定性好;保留 Fc 段,功能可调节。
劣势:融合片段的位置可能影响抗原结合能力,还可能改变抗体的溶解度、稳定性等理化性质。

三、双抗如何对抗肺癌?三大核心作用机制拆解
双抗的优势不仅在于 “双靶点”,更在于其独特的作用机制 —— 它不是两种单抗的简单混合,而是能产生 “1+1>2” 的协同效果。目前,用于肺癌治疗的双抗主要通过三大机制发挥作用(见图 2):
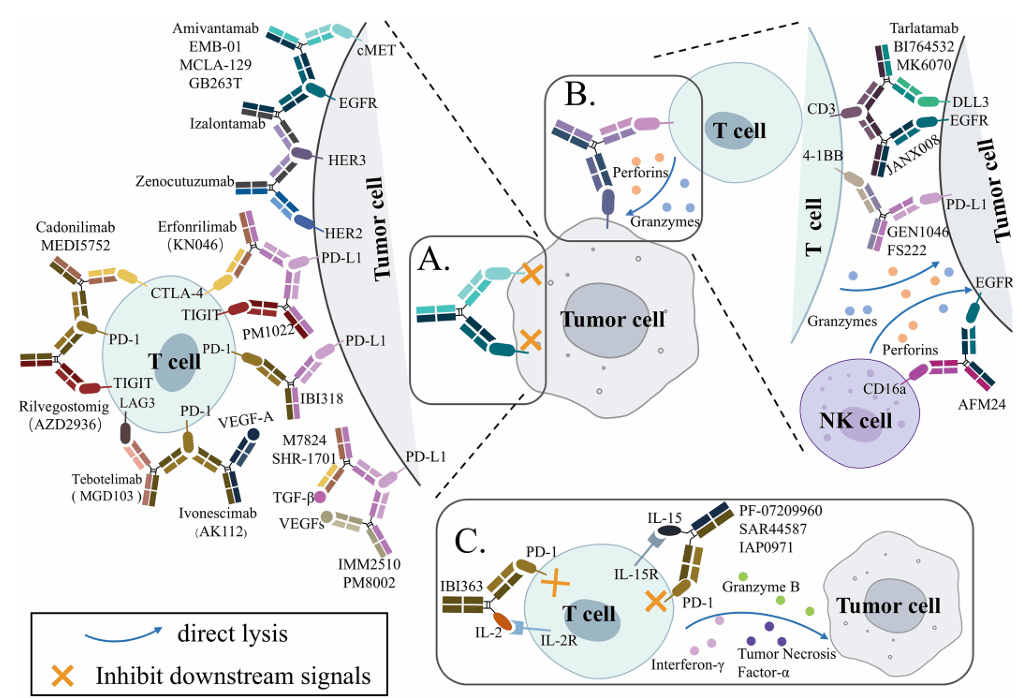
3.1 机制一:双抑制 —— 同时阻断两个致癌信号,破解耐药
这类双抗通过同时靶向两个与肿瘤生长相关的抗原,阻断两条相互关联的信号通路,从而避免肿瘤通过 “代偿通路” 耐药(比如一条通路被阻断,另一条通路激活)。目前超过一半的肺癌双抗采用这种机制,主要分为三类:
靶向 ErbB 家族双受体:破解 “受体 dimer 耐药”
ErbB 家族是肺癌中最关键的致癌受体家族,包括EGFR(HER1)、HER2、HER3、HER4。它们通过 “同源二聚体”(如 EGFR-EGFR)或 “异源二聚体”(如 HER2-HER3)激活下游信号(如 MAPK、PI3K-AKT),促进肿瘤生长 。
当使用单靶点药物(如 EGFR-TKI)时,肿瘤可能通过激活另一个 ErbB 成员(如 HER3)或旁路(如 cMET)耐药。而双抗能同时抑制两个受体,比如:
EGFR×cMET 双抗(如阿米万他单抗):同时阻断 EGFR 和 cMET,避免 cMET 扩增导致的 EGFR-TKI 耐药;
HER2×HER3 双抗(如泽诺库妥单抗):阻断 HER2-HER3 异源二聚体,抑制 NRG1 融合驱动的肿瘤生长。
双免疫检查点阻断:增强免疫激活,降低毒性
肿瘤会利用PD-1/PD-L1、CTLA-4等 “免疫检查点” 抑制 T 细胞活性。传统方案是联合使用两种免疫单抗(如纳武利尤单抗 + 伊匹木单抗),但毒性会叠加(如皮疹、腹泻发生率升高)。
双抗(如 PD-1×CTLA-4 双抗)能优先结合肿瘤微环境中同时表达 PD-1 和 CTLA-4 的 T 细胞,减少对正常组织免疫细胞的激活,在增强疗效的同时降低毒性。
免疫检查点 + 肿瘤微环境因子抑制:同时 “解除免疫抑制” 和 “改善微环境”
肿瘤微环境中的某些因子(如 VEGF、TGF-β)会促进血管异常增生、抑制免疫细胞浸润。双抗(如 PD-L1×VEGF 双抗)能同时阻断 PD-L1(激活免疫)和 VEGF(抑制血管生成、改善微环境),实现协同作用。
3.2 机制二:免疫细胞 “导航员”—— 让免疫细胞精准杀肿瘤
这类双抗被称为免疫细胞衔接器(ICEs),核心是 “连接肿瘤细胞和免疫细胞”,让免疫细胞直接攻击肿瘤。目前最成熟的是T 细胞衔接器(TCEs),此外还有NK 细胞衔接器(NKCEs):
T 细胞衔接器(TCEs):激活 T 细胞 “定向杀瘤”
比如针对 SCLC 的DLL3×CD3 双抗(如塔拉图单抗),能精准结合 SCLC 表面高表达的 DLL3,激活 T 细胞杀瘤。
NK 细胞衔接器(NKCEs):利用天然免疫细胞的优势
NK 细胞是 “天然免疫战士”,无需抗原提呈就能杀肿瘤。NKCEs 的一端结合肿瘤抗原(如 EGFR),另一端结合 NK 细胞表面的激活受体(如 CD16a、NKG2D),让 NK 细胞聚焦肿瘤,释放细胞毒性分子。
这类双抗的优势是:NK 细胞不引起细胞因子释放综合征(CRS)(TCEs 常见副作用),安全性可能更优。
3.3 机制三:免疫细胞因子 —— 精准递送细胞因子,降低全身毒性
细胞因子(如 IL-2、IL-15)是调节免疫的重要分子,早期曾用于癌症治疗,但因半衰期短、全身毒性大(如发热、毛细血管渗漏)而受限。
免疫细胞因子是 “抗体 - 细胞因子融合蛋白”—— 抗体部分靶向肿瘤抗原,将细胞因子 “精准递送到肿瘤微环境”,避免其在正常组织中大量积累;细胞因子部分则激活局部免疫细胞(如 T 细胞、NK 细胞)。
比如PD-1×IL-2 双抗(如 IBI363),抗体部分结合 PD-1(定位肿瘤微环境),IL-2 部分激活肿瘤内的 CD8+T 细胞,既增强杀瘤效果,又减少全身毒性。
四、临床突破:已获批与在研双抗的 “战绩” 如何?
目前已有 3 款双抗获批肺癌适应症,数十款进入临床阶段,覆盖 NSCLC 和 SCLC,部分药物的临床数据让人振奋。
4.1 已获批双抗:3 款药物分别解决哪些临床痛点?
阿米万他单抗(Amivantamab):首个获批肺癌的双抗,破解 EGFR exon20ins 耐药
铂类化疗后进展患者(CHRYSALIS 试验):客观缓解率(ORR)40%,中位缓解持续时间(mDOR)11.1 个月,中位总生存期(mOS)22.8 个月—— 要知道,这类患者此前用化疗的 ORR 仅 10%-20%,mOS 不足 1 年;
一线联合化疗(PAPILLON 试验):中位无进展生存期(mPFS)11.4 个月,显著优于单纯化疗的 6.7 个月。
靶点:EGFR×cMET
获批适应症:2021 年 FDA 获批用于 “铂类化疗后进展的 EGFR exon20 插入突变(EGFR ex20ins)晚期 NSCLC”;2024 年获批联合化疗作为 EGFR ex20ins NSCLC 的一线治疗。
临床数据:
优势:不仅对 EGFR ex20ins 有效,对 EGFR 敏感突变(Ex19del、L858R)耐药患者、MET exon14 跳变患者也有疗效;皮下注射剂型能减少输液反应(从 66% 降至 13%)。
泽诺库妥单抗(Zenocutuzumab):NRG1 融合肺癌的 “克星”
靶点:HER2×HER3获批适应症:2024 年 FDA 加速获批用于 “NRG1 融合阳性晚期 NSCLC”。
临床数据(eNRGy 试验):64 例 NRG1 + 患者中,ORR 34%,mDOR 12.9 个月,50% 患者的缓解仍在持续—— 此前这类患者用化疗的 ORR 仅 13%-14%,mPFS 不足 6 个月。
优势:通过 “高亲和力结合 HER2” 定位肿瘤,再阻断 HER3 与 NRG1 的结合,精准抑制 HER2-HER3 二聚体;糖基化改造增强了 ADCC 活性。
塔拉图单抗(Tarlatamab):SCLC 治疗的 “历史性突破”
靶点:DLL3×CD3
获批适应症:2024 年 FDA 加速获批用于 “铂类化疗后进展的广泛期 SCLC”—— 这是 SCLC 领域多年来首个获批的 TCE 类药物。
临床数据(DeLLphi-301 试验):10mg 剂量组的ORR 40%,mPFS 4.9 个月,mOS 14.3 个月;即使有脑转移的患者,颅内疾病控制率也达 87.5%。
优势:DLL3 在 85%-94% 的 SCLC 中高表达,且正常组织几乎不表达,靶向性强;作为 TCE,能激活 T 细胞直接杀瘤,打破 SCLC 的治疗僵局。
4.2 在研双抗:这些 “潜力选手” 值得关注
除了已获批药物,多款在研双抗的临床数据也展现出潜力:
AK112(Ivonescimab):PD-1×VEGF-A 双抗,挑战一线 NSCLC
临床数据(HARMONi-2 试验):对比 PD-1 单抗(帕博利珠单抗),AK112 用于 PD-L1 阳性(TPS≥1%)晚期 NSCLC 一线治疗时,mPFS 11.14 个月 vs 5.82 个月,ORR 50.0% vs 38.5%—— 显著优于传统 PD-1 单抗。
优势:同时阻断 PD-1(激活免疫)和 VEGF(改善肿瘤微环境),协同作用强;2024 年已在中国获批联合化疗用于 EGFR-TKI 耐药的 EGFR 突变 NSCLC。
KN046(Erfonrilimab):PD-L1×CTLA-4 双抗,覆盖 EGFR 耐药患者
临床数据(KN046-201 试验):用于 EGFR-TKI 耐药、未接受过化疗的晚期 NSCLC 患者,联合化疗的ORR 26.9%,mOS 20.2 个月—— 为 EGFR 耐药患者提供了新的免疫联合方案。
IBI363:PD-1×IL-2 双抗,突破 IL-2 毒性瓶颈
临床数据( phase I 试验):用于晚期 NSCLC 时,ORR 24.1%,3mg/kg 剂量组 ORR 高达 85.7%;更关键的是,其采用 IL-2Ra 偏向设计,能精准激活肿瘤内的 CD8+T 细胞,避免传统 IL-2 的全身毒性,3mg/kg 剂量仍安全。
五、双抗治疗肺癌:仍需跨越的四大挑战
尽管双抗的临床进展喜人,但要成为肺癌治疗的 “主流方案”,仍需解决四大核心挑战:
5.1 生产挑战:高成本如何降下来?
双抗的生产比单抗复杂得多:
表达量低:即使经过优化,双抗的细胞表达量仍低于单抗;
纯化难:需通过 “亲和层析 + 离子交换层析 + 体积排阻层析” 等多步纯化,才能去除错配、聚合体等杂质;
成本高:复杂的生产和纯化流程导致双抗价格昂贵,可能限制患者可及性。
未来需通过工艺优化(如提高细胞表达量、简化纯化步骤)降低成本。
5.2 免疫原性风险:抗药抗体如何避免?
现状:不同双抗的免疫原性差异大,比如阿米万他单抗的 ADAs 发生率低,但部分双抗的 ADAs 发生率较高;
解决方向:从分子设计(如优化人源化改造)、生产工艺(如减少杂质、避免聚合)、临床方案(如调整剂量、给药频率)多方面入手,降低免疫原性。
5.3 副作用:如何平衡疗效与安全性?
双抗的副作用与其机制密切相关,常见问题包括:
细胞因子释放综合征(CRS):TCE 类双抗的典型副作用,因 T 细胞过度激活释放大量细胞因子导致,表现为发热、低血压等。比如塔拉图单抗的 CRS 发生率为 51%(10mg 剂量组);
靶相关毒性:双抗同时靶向两个抗原,可能对表达这些抗原的正常组织造成损伤。比如 EGFR×cMET 双抗可能引发皮疹(EGFR 相关)、外周水肿(cMET 相关);
肺毒性:肺癌患者本身肺功能可能较差(如吸烟史),药物诱导的肺炎可能加重病情,甚至致命。
解决方向:通过 “亲和力调节”(如降低 CD3 亲和力减少 CRS)、“肿瘤靶向设计”(如 prodrug 形式的 TCE,仅在肿瘤内激活)、“给药方式优化”(如皮下注射减少输液反应)等策略,降低副作用。
5.4 肿瘤异质性与微环境限制:如何让双抗 “穿透更深、起效更广”?
肿瘤异质性:同一患者的肿瘤细胞可能表达不同抗原,导致双抗仅对部分病灶有效;
微环境屏障:肿瘤血管异常、间质压力高,会阻碍双抗穿透到肿瘤内部;同时,肿瘤微环境中的 immunosuppressive 细胞(如 Treg)会抑制双抗激活的免疫反应。
解决方向:开发 “多靶点双抗”(如同时靶向 3 个抗原)覆盖异质性,或联合抗血管生成药物(如安罗替尼)改善微环境,增强双抗的穿透性。
六、未来展望:双抗如何进一步改写肺癌治疗格局?
尽管有挑战,但双抗的发展前景广阔,未来将从以下方向突破:
6.1 新靶点开发:从 “成熟靶点” 到 “小众刚需”
目前双抗主要靶向 EGFR、PD-1、DLL3 等成熟靶点,未来将聚焦更多 “小众但关键” 的靶点,比如:
NRG1 融合:在 NSCLC 中发生率约 0.3%-1%,但尚无特效药物,HER2×HER3 双抗(如泽诺库妥单抗)已展现潜力 ;
MET exon14 跳变:EGFR-TKI 耐药的重要原因,EGFR×cMET 双抗(如阿米万他单抗)已证实有效;
新免疫检查点:如 LAG-3、TIGIT,PD-1×LAG-3 双抗(如 Tebotelimab)、PD-1×TIGIT 双抗(如 AZD2936)已进入临床。
6.2 联合治疗:1+1+1>3 的协同效应
双抗与其他疗法的联合将成为趋势:
双抗 + 化疗:如阿米万他单抗联合化疗用于 EGFR ex20ins 一线治疗;
双抗 + 靶向药:如 MCLA-129(EGFR×cMET)联合奥希替尼用于 EGFR 耐药患者;
双抗 + 放疗:放疗能增强肿瘤抗原释放,与双抗协同激活免疫。
6.3 个体化治疗:基于生物标志物精准选药
未来将通过检测患者的抗原表达(如 DLL3、PD-L1)、基因突变(如 EGFR、MET),为患者匹配最适合的双抗 —— 比如 DLL3 高表达的 SCLC 患者用塔拉图单抗,EGFR ex20ins 患者用阿米万他单抗,实现 “精准治疗”。
结语





