▲体内CAR疗法-全球研究与发展格局(2025)免费领取!
摘要: 结核病(TB)作为全球致死率最高的传染病之一,每年导致数百万人死亡,全球约 1/3 人口感染结核分枝杆菌(Mtb)。目前唯一获批的疫苗是卡介苗(BCG),但它在成人肺结核防护、免疫功能低下人群安全性等方面存在明显局限。本文将从结核病的流行现状与免疫机制入手,分析 BCG 疫苗的优缺点,介绍 subunit 疫苗、全细胞疫苗等新一代疫苗候选者的研发进展,为读者清晰呈现结核病疫苗领域的关键信息。
一、结核病:不容忽视的全球健康威胁
结核病由结核分枝杆菌(Mtb)引起,是全球十大致死病因之一,尤其在发展中国家形势严峻。数据显示,2018 年全球 57% 的感染者为男性,32% 为女性,11% 为儿童,且约 8.6% 的患者合并感染人类免疫缺陷病毒(HIV)。
Mtb 进入人体后,会被肺泡巨噬细胞和树突状细胞吞噬,但它能在吞噬细胞内存活,并抑制吞噬体 - 溶酶体成熟,随后通过树突状细胞转移至淋巴结,引发 T 淋巴细胞免疫反应。不过,免疫系统往往无法彻底清除 Mtb,而是形成肉芽肿,将细菌限制在潜伏状态(LTBI)。当人体免疫功能减弱时,潜伏的 Mtb 会重新激活,发展为活动性结核病,破坏肺部组织,引发咳嗽、发热、盗汗等症状。
值得注意的是,多重耐药(MDR)结核菌株的出现让治疗更加困难,全球约有 5000 万 MDR 结核病例,而长期且复杂的药物治疗方案导致患者依从性差,进一步加剧了结核病的防控难度。
二、BCG 疫苗:当前唯一选择,却有明显短板(一)BCG 疫苗的发展与作用
卡介苗(BCG)是目前全球唯一获批用于预防结核病的疫苗,由牛分枝杆菌(M. bovis)经多次传代减毒制成,自 1921 年首次用于人体以来,已接种超过 30 亿人次,每年约有 1 亿新生儿接种。
BCG 疫苗对儿童重症结核病(如结核性脑膜炎)有较好的保护效果,能有效降低儿童结核病死亡率。其作用机制主要是激活Th1 型免疫反应,诱导产生肿瘤坏死因子 -α(TNF-α)、γ- 干扰素(IFN-γ)等细胞因子,增强机体对 Mtb 的抵抗力。
(二)BCG 疫苗的局限性
尽管 BCG 疫苗应用广泛,但存在诸多不可忽视的短板:
对成人肺结核保护效果有限:成人是活动性结核病的主要人群,而 BCG 疫苗无法有效预防成人肺结核,这也是结核病在人群中传播的重要原因。
免疫功能低下人群风险高:HIV 感染者、免疫缺陷儿童等人群接种 BCG 疫苗后,可能引发播散性卡介苗病等严重并发症,因此 WHO 已建议 HIV 高风险婴儿不再接种 BCG。
地域差异明显:在结核病流行的发展中国家,由于人群可能提前接触环境中的非结核分枝杆菌,产生交叉免疫反应,导致 BCG 疫苗保护效果下降;而在发达国家,BCG 疫苗效果相对更稳定。
无治疗价值:BCG 疫苗仅用于预防,对已感染 Mtb 或处于潜伏感染状态的人群,无法起到治疗或阻止病情进展的作用。
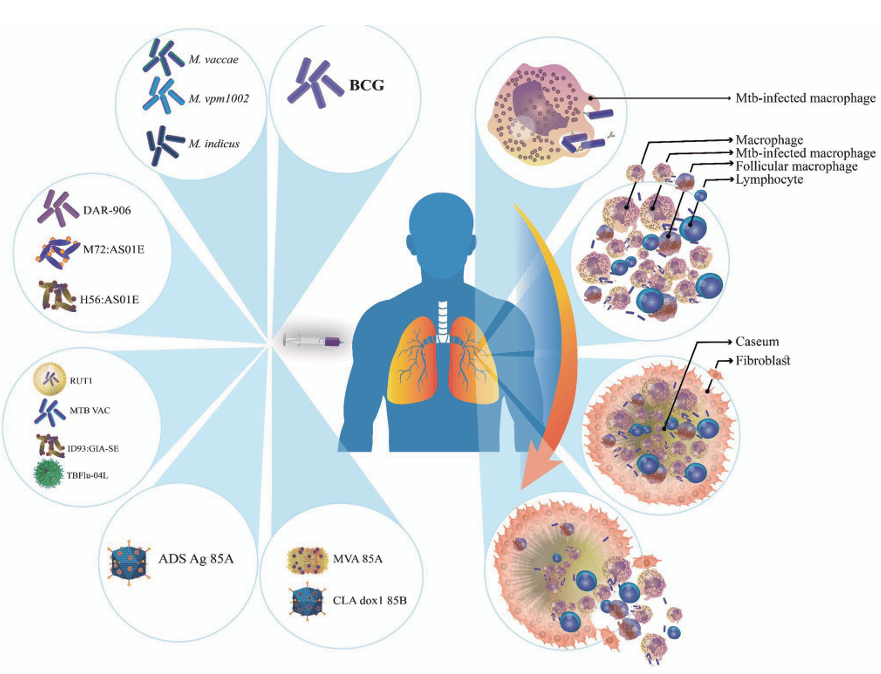
图 1:结核分枝杆菌(Mtb)致病周期,左侧为已获批和试验中的疫苗,右侧为 Mtb 进入巨噬细胞、肉芽肿形成及释放到呼吸道的过程。
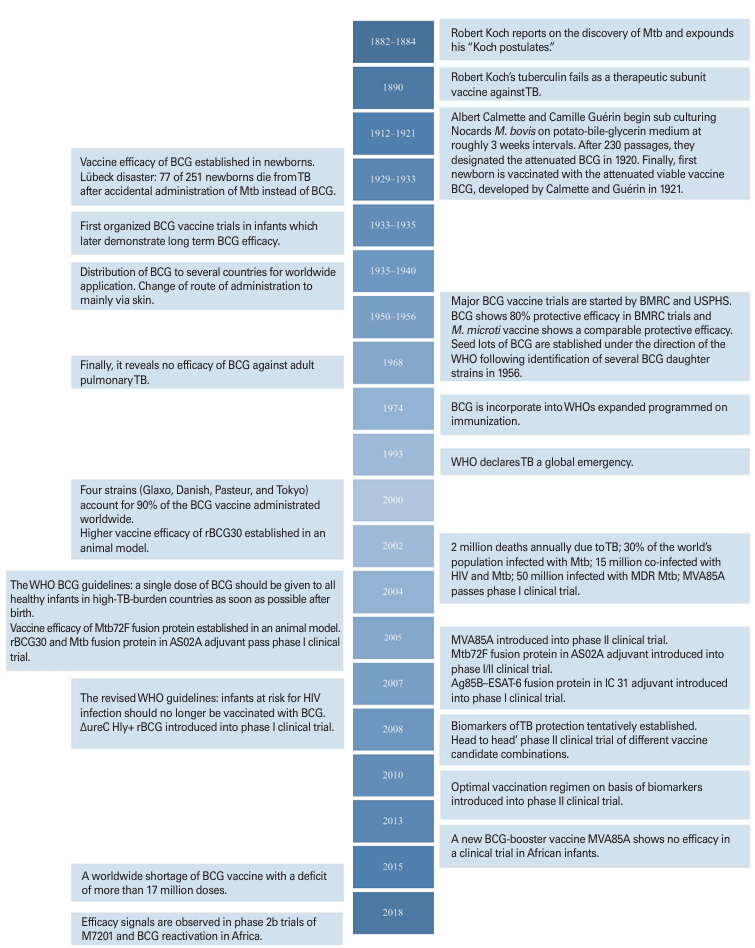
图 2:结核病疫苗发展时间线,包含 BCG 疫苗的关键事件、新型疫苗研发节点等内容。
三、新一代疫苗研发:多方向突破,有望弥补 BCG 短板
为解决 BCG 疫苗的不足,科研人员围绕不同技术路线开展新一代结核病疫苗研发,主要包括 subunit 疫苗、全细胞疫苗、病毒载体疫苗等,部分候选疫苗已进入临床试验阶段。
(一)subunit 疫苗:成分明确,安全性高
subunit 疫苗选取 Mtb 的关键抗原(如 ESAT-6、Ag85B 等),结合佐剂制成,具有成分明确、安全性高、易于大规模生产等优点,主要作为 BCG 疫苗的加强剂使用,以增强免疫保护效果。
常见的 subunit 疫苗候选者及其特点如下表所示:
表1:subunit 疫苗的成分、免疫特性及参考来源,包含 M72、H56、ID93 等多种疫苗候选者信息。
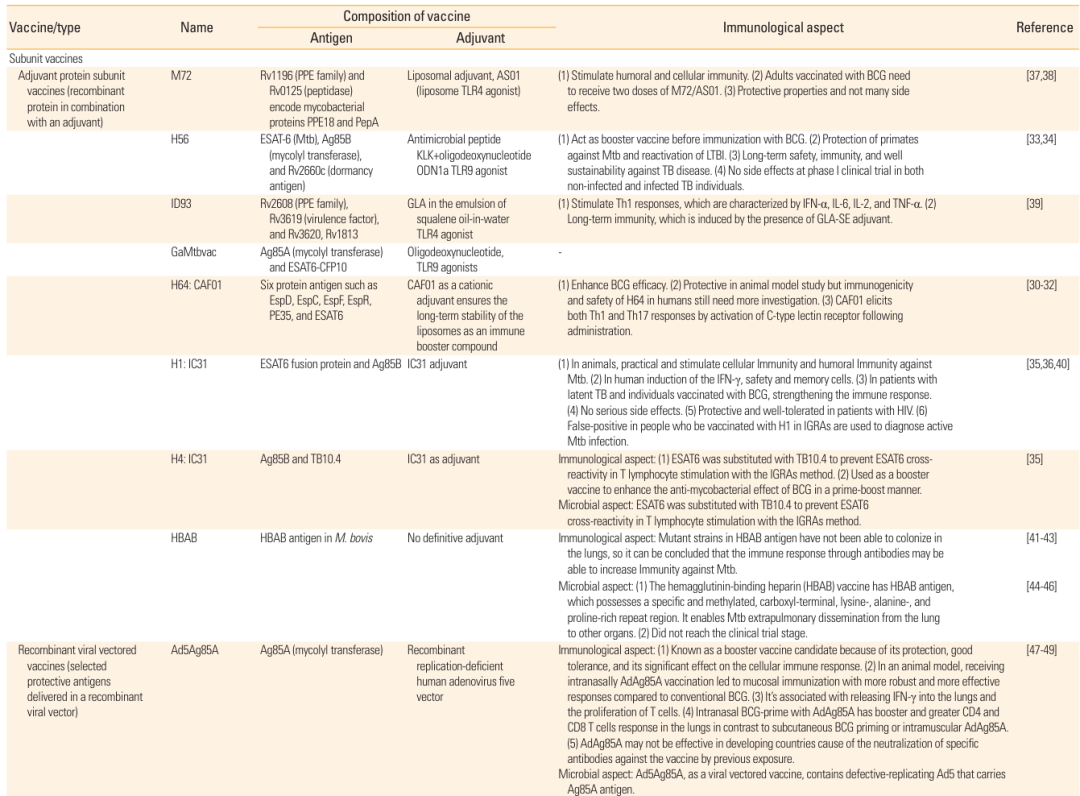
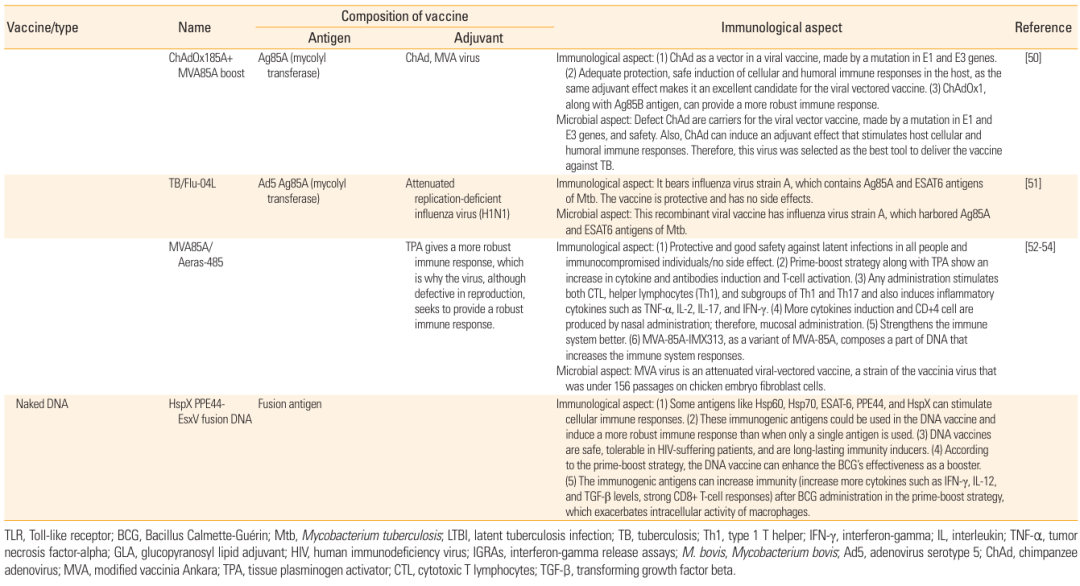
以 M72/AS01E 疫苗为例,它由 Mtb 的 PPE18 和 PepA 蛋白组成,搭配 AS01 佐剂,能同时激活体液免疫和细胞免疫,在临床试验中显示出良好的安全性,对成人结核病有一定保护效果;H56/IC31 疫苗则包含 ESAT-6、Ag85B 和休眠抗原 Rv2660c,可用于预防潜伏性结核病激活,在动物实验中能有效减少 Mtb 载量。
(二)全细胞疫苗:模拟天然感染,免疫应答全面
全细胞疫苗分为减毒活疫苗和灭活疫苗,前者通过基因修饰降低 Mtb 或 M. bovis 的毒性,后者则是将 Mtb 或非结核分枝杆菌加热灭活制成,能模拟天然感染过程,诱导更全面的免疫应答。
表2:全细胞疫苗的修饰方式、微生物特性及免疫特性,包含 VPM1002、MtbVAC、M. vaccae 等疫苗候选者。
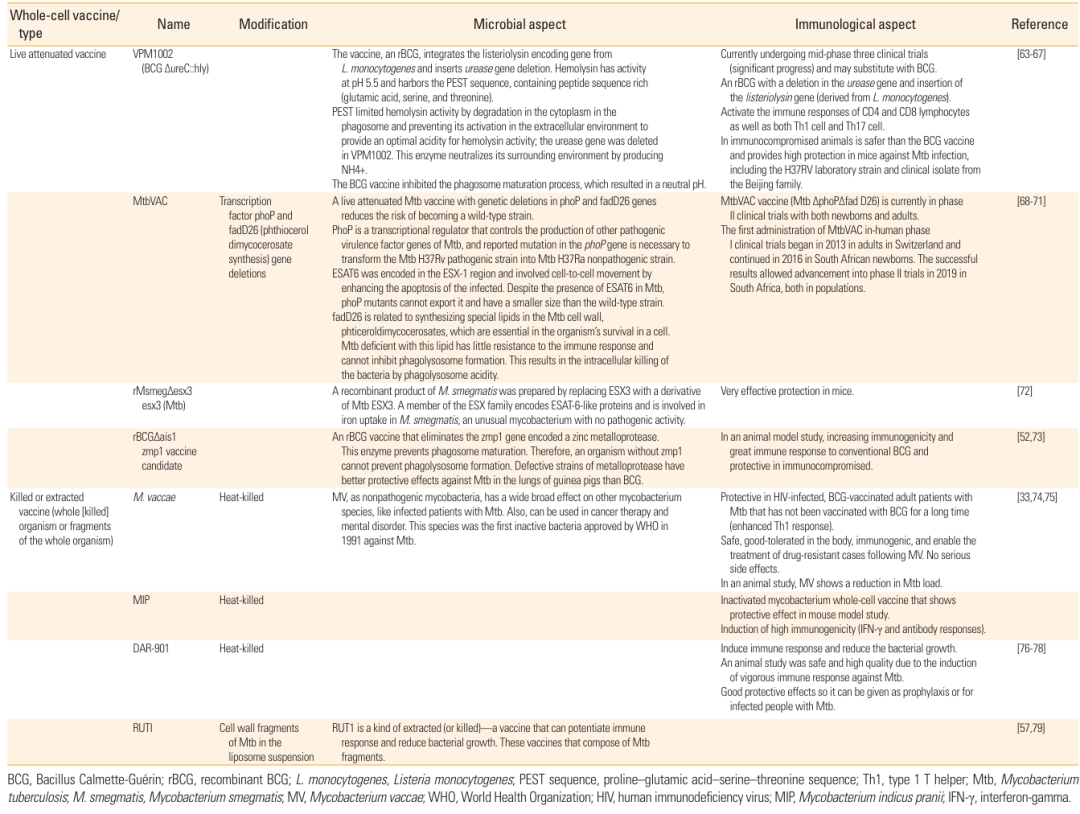
VPM1002 是一种重组 BCG 疫苗,通过敲除尿素酶基因并插入李斯特菌溶血素基因,增强了疫苗在巨噬细胞内的抗原呈递效率,目前已进入 Ⅲ 期临床试验,在 HIV 感染者中显示出良好的安全性;MtbVAC 则是通过敲除 Mtb 的 phoP 和 fadD26 基因实现减毒,能有效激活 Th1 和 Th17 免疫反应,对耐药菌株也有一定保护效果,目前处于 Ⅱ 期临床试验阶段。
(三)疫苗佐剂:增强免疫应答的关键
表 3:结核病疫苗候选者中使用的佐剂,包含佐剂成分、作用机制及诱导的免疫反应类型。
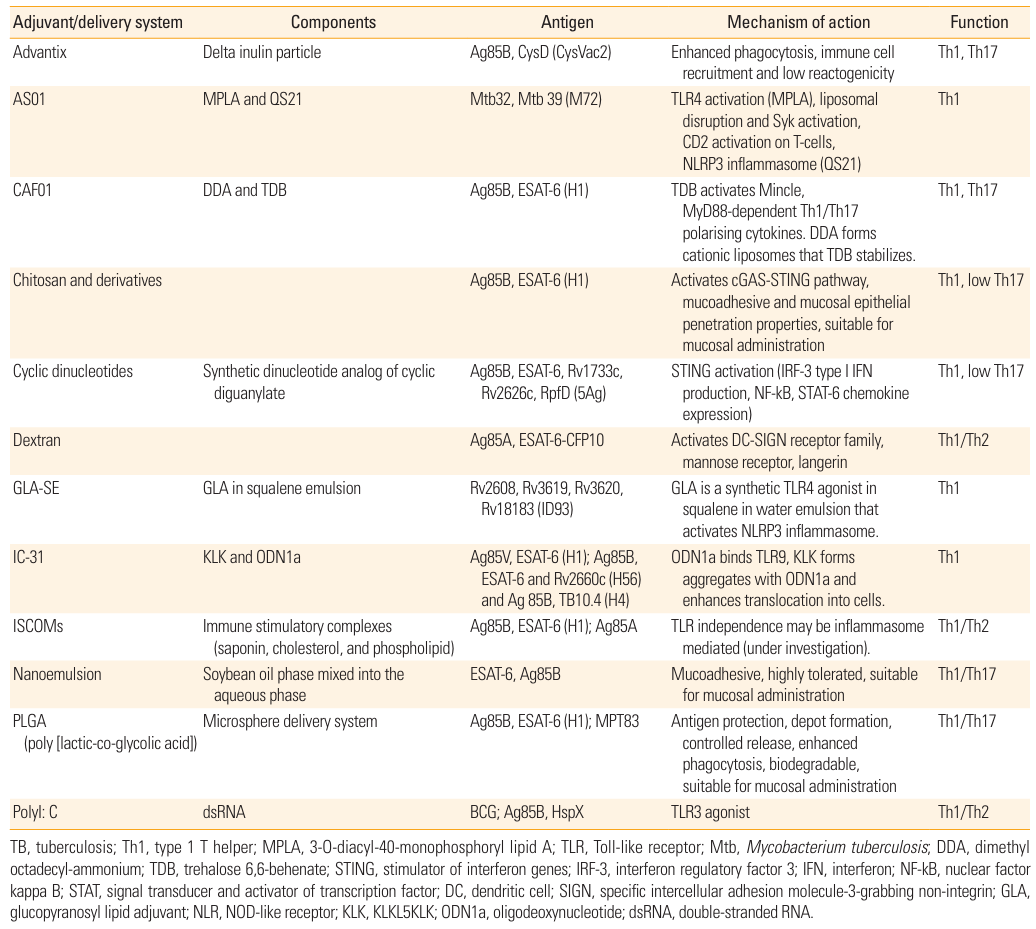
例如,AS01 佐剂包含 MPLA(TLR4 激动剂)和 QS21,能有效激活 Th1 型免疫反应;IC31 佐剂由 KLK 肽和 ODN1a(TLR9 激动剂)组成,可增强抗原特异性 T 细胞应答,延长免疫记忆时间。
四、未来展望:多策略结合,攻克结核病
尽管新一代结核病疫苗研发取得了显著进展,但仍面临诸多挑战,如如何进一步提升疫苗对成人和耐药菌株的保护效果、如何找到能准确评估疫苗保护效果的生物标志物(目前常用的 IFN-γ 单独使用存在局限性)等。
未来,科研人员将继续优化疫苗设计,探索 “初免 - 加强” 免疫策略(如 BCG 初免 + subunit 疫苗加强),同时结合新型佐剂和递送系统,提升疫苗的免疫原性和安全性。此外,针对 Mtb 潜伏感染的治疗性疫苗也将成为研发重点,以期实现 “预防 + 治疗” 双重目标,最终推动全球结核病防控达到 WHO 提出的 “终止结核病战略” 要求。
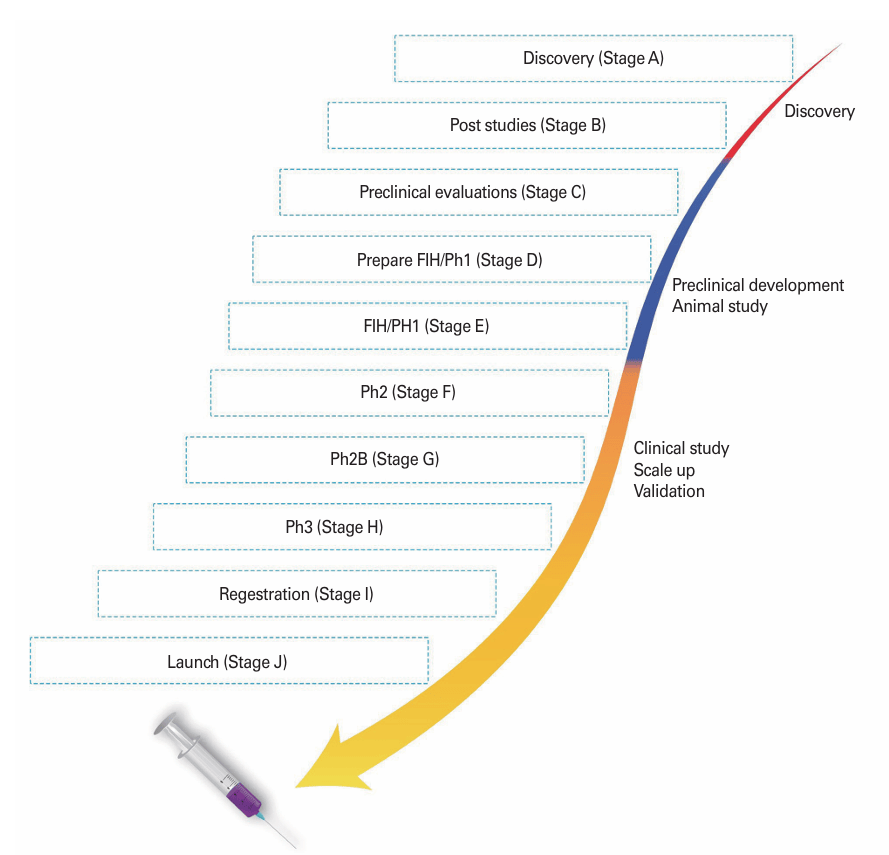
图3:结核病疫苗研发路径,从发现阶段到上市阶段的各个关键步骤。
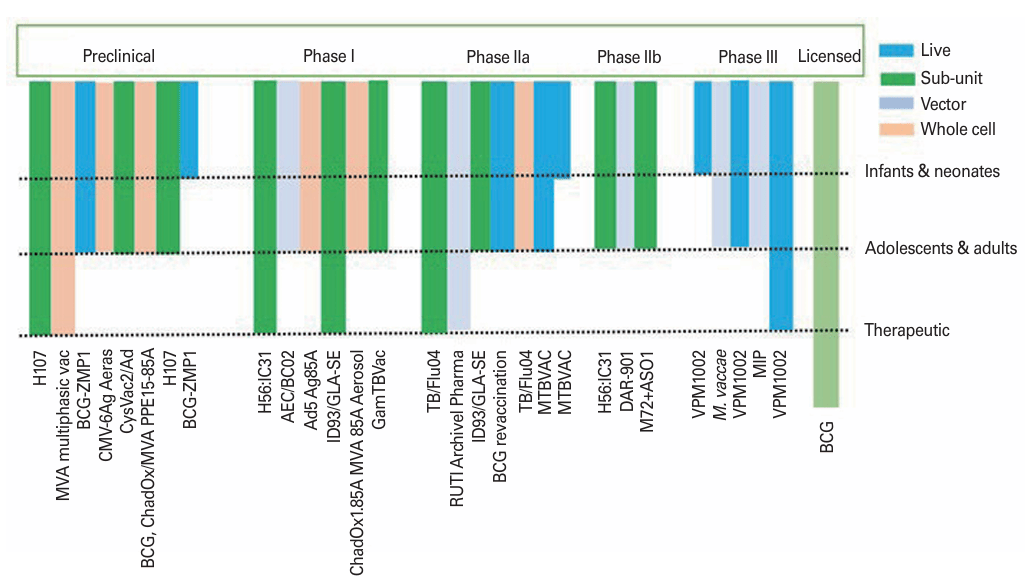
图4:结核病疫苗临床试验进展,按疫苗类型、目标人群、临床试验阶段分类展示。





